时间:2017-11-05 23:52:55
1、填空题 (9分)人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学
技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)电子表和电子计算器中所用的是纽扣式微型银锌电池,其电极分别为Ag2O和Zn,工作时电池总反应为Ag2O+Zn+H2O===2Ag+Zn(OH)2。
①工作时电子从________极流向________极(填“Ag2O”或“Zn”)。其用到的电解质溶液是?(填“KOH ”或"H2SO4")
②电极反应式:正极____________________________________________,
③工作时电池电解质溶液pH________(填“增大”、“减小”或“不变”)。
(2) 2009年10月,中国科学院长春应用化学研究所在甲醇(CH3OH一种可燃物)燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如右图所示。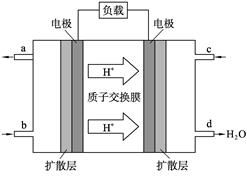
①该电池工作时,b口通入的物质为____________, c口通入的物质为__________。
②该电池正极的电极反应式___________?
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有___________NA个电子转移。
参考答案:(1)①Zn ; Ag2O;? KOH
②Ag2O+H2O+2e-=2Ag+2OH-?③增大
(2)①CH3OH;? O2?②O2+4H++4e-=2H2O?③1.2
本题解析:考查原电池的有关判断及计算。
(1)在原电池中负极失去电子,经导线传递到正极上。根据反应式可知锌上负极,氧化银上正极,所以电子从锌极流向氧化银极。由于锌上活泼的金属,所以电解质溶液不能酸性溶液,而是碱性溶液,即为氢氧化钾。氧化银上正极,正极得到电子,电极反应式为Ag2O+H2O+2e-=2Ag+2OH-。根据总反应式可知,反应后生成了氢氧化锌,所以溶液的碱性是增强的,即陪÷
H是增大的。
(2)在原电池中负极失去电子,经导线传递到正极上,所以溶液中的阳离子向正极移动。根据装置图可知氢离子向右侧移动,所以右侧电极是正极,左侧是负极。在燃料电池中负极是通入可燃物的,即甲醇在左侧通入,所以b处通入的是甲醇,c处通入的是氧气。由于氢离子向正极移动,所以正极电极反应式为O2+4H++4e-=2H2O。甲醇的氧化产物是CO2,碳的化合价升高4-(-2—)=6个单位,所以6.4g甲醇完全反应失去的电子是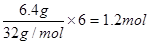 。
。
本题难度:一般
2、选择题 下列各装置中,能构成原电池的是(?)

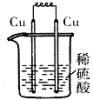
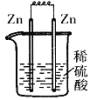
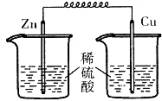
A? B? C? D
参考答案:A
本题解析:构成原电池的条件是活泼性不同的金属或金属和非金属,导线相连且插入电解质溶液中,所以A正确。B和C中电极相同,D中没有形成完整的闭合回路。答案是A。
本题难度:简单
3、填空题 如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL1.0mol/L。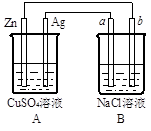
(1)A为?池,(填原电池、或电解池),其中的Ag极为?极,发生?反应(填“氧化”或“还原”)。
(2)B装置中的电极b极为?极,电极反应式为?,总反应的化学方程式为?。经过一段时间后,B装置中溶液的碱性?(填“增强”、“减弱”或“不变”)
(3)若工作一段时间后,当Zn片质量减少3.25g时,a极逸出的气体在标准状况下的体积为?L。
参考答案:(1)原电池;正;还原
(2)阴;2H++2e-=H2↑;2NaCl+2H2O 2NaOH+H2↑+Cl2↑;增强; (3)1.12
2NaOH+H2↑+Cl2↑;增强; (3)1.12
本题解析:(1)锌与硫酸铜可以发生自发的氧化还原反应,因此A装置是原电池。原电池中较活泼的金属作负极,则锌是负极失去电子,发生氧化反应,银是正极,溶液中的铜离子在正极得到电子发生还原反应。
(2)B装置是电解池,b电极与原电池的负极相连作阴极,溶液中的氢离子放电,电极反应式为2H++2e-=H2↑。A电极与原电池的正极相连,作阳极,溶液中的氯离子放电生成氯气,则B装置中总的化学方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。B装置中有氢氧化钠强碱生成,因此溶液的碱性增强。
2NaOH+H2↑+Cl2↑。B装置中有氢氧化钠强碱生成,因此溶液的碱性增强。
(3)若工作一段时间后,当Zn片质量减少3.25g时,其中锌的物质的量是3.25g÷65g/mol=0.05mol,根据电极反应式Zn-2e-=Zn2+可知导线中转移电子的物质的量是0.05mol×2=0.1mol。a极电极反应式为2Cl--2e-=Cl2↑,则根据电子转移守恒可知逸出的氯气在标准状况下的体积为0.05mol×22.4L/mol=1.12L。
本题难度:一般
4、选择题 干电池的总反应方程式为Zn+2H+═Zn2++H2↑,下列说法中正确的是( )
A.锌作负极,发生氧化反应
B.锌作正极,发生氧化反应
C.锌作正极,发生还原反应
D.锌作负极,发生还原反应
参考答案:A.Zn失去电子,为负极,发生氧化反应,故A正确;
B.Zn失去电子,为负极,发生氧化反应,故B错误;
C.Zn失去电子,为负极,发生氧化反应,故C错误;
D.Zn失去电子,为负极,发生氧化反应,故D错误;
故选A.
本题解析:
本题难度:一般
5、填空题 以氯化钾和硫酸亚铁原料生产硫酸钾和氧化铁红颜料,其主要流程如下:
已知: 溶液呈碱性,30℃以上溶液中
溶液呈碱性,30℃以上溶液中 大量分解。
大量分解。
(1)写出 溶液中的物料守恒___________________________________
溶液中的物料守恒___________________________________
(2)写出沉淀池I中反应的化学方程式_______________________,该反应必须控制的反应条件是___________________________。
(3)检验沉淀I中 沉淀是否完全的方法是__________________________________。
沉淀是否完全的方法是__________________________________。
(4)酸化的目的是___________________________。
(5)在沉淀池II中,为使 晶体分离出来用到过滤操作,过滤时用到的主要玻璃仪器是__________________________。
晶体分离出来用到过滤操作,过滤时用到的主要玻璃仪器是__________________________。
(6)N、P、K、S都是植物生长所需的重要元素。滤液A可做复合肥料,因为其中含有___________等元素。
(7)中国海洋大学应用化学研究所在乙醇燃料电池技术方面获得突破,组装出了自呼吸电池及主动式电堆。乙醇燃料电池的工作原理如图怕示。
①该电池工作时,c口通入的物质为___________。
②该电池负极的电极反应式为_____________________________________。
参考答案:(1)[NH4+]+[NH3?H2O]=[CO32?]+[H2CO3]+[HCO3?] (2分)
(2)2NH4HCO3 + FeSO4 = FeCO3↓+ (NH4)2SO4 + CO2↑+ H2O (2分);反应温度低于30℃ (1分)
(3)取沉淀池Ⅰ的滤液,滴加KSCN溶液后滴加氯水,若无红色出现,说明沉淀完全。(合理即可)(2分)
(4)除去溶液中的HCO3? (2分)
(5)普通漏斗、烧杯、玻璃棒(2分 不全得1分,下同)
(6)K、S 、K?(2分)
(7)O2(1分);C2H6O – 12e? + 3H2O = 2CO2 +12H+(2分)
本题解析:(1)物料守恒的实质是元素守恒,NH4HCO3溶液中N元素与C元素物质的量相等,所以[NH4+]+[NH3?H2O]=[CO32?]+[H2CO3]+[HCO3?]
(2)碳酸氢根离子和亚铁离子之间发生双水解反应生成碳酸亚铁沉淀,并放出二氧化碳,反应的原理方程式为:2NH4HCO3+FeSO4=FeCO3↓+(NH4?)2SO4+CO2↑+H2O,为防止较高温度下碳酸氢铵的分解,要注意温度的选择,反应温度低于30℃。
(3)亚铁离子可以被氯气氧化为三价铁离子,亚铁离子遇到硫氰酸钾不显色,但是三价铁遇到硫氰酸钾显示红色,检验沉淀池I中Fe2+沉淀是否完全的方法是:取沉淀池I的滤液,滴加KSCN溶液后滴加氯水,若无红色出现,说明沉淀完全。
(4)沉淀池Ⅰ中,除了生成的碳酸亚铁之外,溶液汇总会含有过量的碳酸氢铵,加入酸,酸化的目的是除去溶液中的HCO3-。?
(5)由题目看出在Ⅲ反应中生成的K2SO4为固体,而K2SO4在无机溶剂中溶解度是比较大的,要想使K2SO4析出只能降低其溶解度所以加入醇类溶剂目的降低K2SO4的溶解度。
(6)滤液A的成分中含有(NH4?)2SO4以及KCl,即含有N、S、K元素,属于复合肥料。
(7)根据图中H+移动方向,可知右侧电极为燃料电池的正极,所以c口通入的物质为O2;由图可知电解质溶液中含H+,所以乙醇和水反应,根据化合价的变化,C2H5OH失去12e?,可得电极方程式:C2H6O – 12e? + 3H2O = 2CO2 +12H+
本题难度:一般