时间:2017-11-05 23:51:22
1、选择题 下列原子或离子原子核外电子排布不属于基态排布的是
A.N: 1s22s22p3
B.S2-: 1s22s22p63s23p6
C.Na: 1s22s22p53s2
D.Si: 1s22s22p63s23p2
参考答案:C
本题解析:试题分析:基态电子排布是根据构造原理电子从能量低的轨道一次进入能量高的轨道的排布。这样使整个原子处于能量最低状态。C中Na原子的2p轨道还没有排满就去排3s轨道,所以不是能量最低状态,不是基态电子排布。所以答案选C。考点:核外电子排布点评:从构造原理图中可以看出能级的能量高低除了符合E(ns)<E(np)<E(nd)<E(nf)和E(1s)<E(2s)<E(3s)<E(4s)等规律之外,还存在一些不同能层的能级的交错现象。例如,E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。
本题难度:一般
2、选择题 某元素R的原子核外电子数等于核内中子数。取该元素单质2.8 g与足量O2化合,可得6 g氧化物RO2,则该元素在周期表中的位置是
[? ]
A.第三周期
B.第二周期
C.ⅤA族
D.ⅤⅠA族
参考答案:A
本题解析:
本题难度:一般
3、填空题 判断下列各组中两种物质的关系,将其序号填写在表格中:
①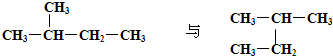
②CH3COOH和HCOOCH3
③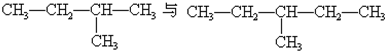
④
⑤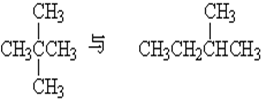
⑥16O、17O、18O?⑦金刚石和石墨;
| 类别 | 同素异形体 | 同分异构体 | 同位素 | 同种物质 组号 ______ ______ ______ ______ 参考答案:因同种元素组成的不同单质称为同素异形体,属单质,故答案为:⑦; 本题解析: 本题难度:简单 4、选择题 下列关于物质性质变化的比较,不正确的是( ) 参考答案:A.非金属性:S>P>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强, 本题解析: 本题难度:简单 5、填空题 已知A2-、B-、C+、D2+、E3+五种简单离子的核外电子数相等,则它们对应的离子半径由大到小的顺序是______. 参考答案:A2-、B-、C+、D2+、E3+五种简单离子的核外电子数相等,所以它们具有相同的电子层结构,则E元素的原子序数最大,原子序数关系为:E>D>C>B>A,核外电子排布相同的离子,原子序数越大,离子半径越小, 本题解析: 本题难度:一般 |