时间:2017-11-05 23:34:51
1、填空题 (1)Fe3+可以与SCN-、CN-、F-、有机分子等形成很多的配合物。
①写出基态Fe3+的核外电子排布式?。
②已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为?。
③下图是SCN-与Fe3+形成的一种配合物,画出该配合物中的配位键(以箭头表示)。
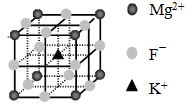
④F-不仅可与Fe3+形成[FeF6]3+,还可以与Mg2+、K+形成一种立方晶系的离子晶体(如下图)。该晶体的化学式为?。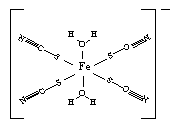 ?
?
(2)氨气是一种重要的化工原料。
①液氨和水类似,也能发生电离:NH3+NH3 NH4++NH2-,其离子积常数为l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应生成NaNH2,假设溶液的体积不变,所得溶液中NH4+的浓度
NH4++NH2-,其离子积常数为l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应生成NaNH2,假设溶液的体积不变,所得溶液中NH4+的浓度
为?。
②已知:N2(g)+O2(g)=2NO(g)?△H=+180kJ·mol-l
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)?△H=-908 kJ·mol-l
写出氨气被一氧化氮氧化生成氮气和气态水的热化学方程式:?。
(3)在下图装置中,若通电一段时间后乙装置左侧电极质量增加。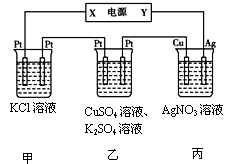
①下列说法错误的是?;
A.乙中左侧电极反应式:Cu2++2e-=Cu
B.电解一段时间后,装置丙的pH减小
C.向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态
D.电解一段时间后,向乙中加入0.1molCu(OH)2可使电解质溶液复原,则电路中通过的电子为0.2mol②若将甲中溶液换成MgCl2,则电解总反应的离子方程式为;
③若Cu电极上质量增加2.16 g, 甲溶液体积为200mL, 则甲溶液的pH=?。
2、选择题 分子有极性分子和非极性分子之分。下列对极性分子和非极性分子的认识不正确的是
[? ]
A.只含非极性键的分子一定是非极性分子
B.含有极性键的分子一定是极性分子
C.非极性分子可能含有非极性键,也可能含有极性键,或同时含有极性键和非极性键
D.极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂
3、选择题 下列物质的化学式及其对应的名称均正确的是( )
A.(NH4)2SO4--硫酸氨
B.KAl(SO4)2--明矾
C.S--硫磺
D.FeS2--硫化亚铁
4、选择题 下列物质中属于离子化合物的是( )
A.苛性钾
B.碘化氢
C.硫酸
D.醋酸
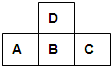
5、选择题 如图为周期表中短周期的一部分,若A原子的最外电子层上有5个电子,则下列说法中不正确的是( )
A.D的单质可跟B的氢化物的水溶液反应
B.A的高价氧化物对应水化物比B的高价氧化物对应水化物的酸性弱
C.B的氢化物比C的氢化物稳定
D.原子半径A>B>C