时间:2017-11-05 23:34:29
1、填空题 (14分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO2-4"等杂质离子,实验室提纯NaCl的流 程如下:
程如下: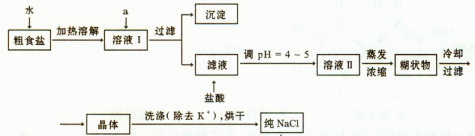
提供的试剂:饱和Na2CO3溶液?饱和K2CO3溶液? NaOH溶液? BaCl2溶液? Ba(NO3)2溶液? 75%乙醇?四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO2-4离子,选出a所代表的试剂,按滴加顺序依次为?(填化学式);滤液中滴加盐酸调pH ="4" ~5的目的是?;
②选用75%乙醇洗涤除去NaCl晶体表面附带的少量KCl,检验NaCl是否洗净的操作是?;
(2)用提纯的NaCl配制480mL 4.00mol·L-1NaCl溶液,需要称取的质量为?g,所用仪器除药匙、玻璃棒、烧杯外还有?(填仪 器名称);
器名称);
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2____(填“>”、“=”或“<”)2L,主要原因是?。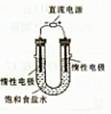
参考答案:(1)①BaCl2、、NaOH、Na2CO3或、NaOH、BaCl2、Na2CO3或BaCl2、、Na2CO3、
NaOH(2分)(错选、多选不得分)②中和溶液中过量的OH-、CO32-;(2分)(2)用干
净的铂丝取最后一次洗涤液放在火焰上灼烧,透过蓝色钴玻璃未见紫色则已洗干净;(2分)
(2)117(2分),天平、500mL容量瓶、胶头滴管;(2分)(3)<,(2分)电解生成的
Cl2与NaOH反应. (2分)
本题解析:(1)欲除去粗盐溶液中的Ca2+、Mg2+、Fe3+、SO42-离子,分别用Na2CO3、、NaOH、
NaOH 、BaCl2且所加试剂要过量,过量的试剂在后续操作中被除,因此Na2CO3、加在
BaCl2后,过量的Na2CO3、、NaOH可用盐酸除;当洗涤液中无K+,则洗干净了,因此取最
后一次洗涤液做焰色反应即可;(2)由于没有480mL容量瓶,所以只能配500mL 溶液,即
0.5x4.00x58.5=117;(3)由于Cl2与NaOH反应而使收集的Cl2<2L。
本题难度:一般
2、推断题 某工业废水中含有Ba2+,Cu2+,Ag+,选择合适试剂,将这三种离子逐一沉淀分离。其流程图如下:
(1)沉淀1的化学式为________________
(2)写出混合液+A的离子方程式_____________________
(3)若C为Na2S;且它与B属于同一类盐,则B试剂的名称是________________ 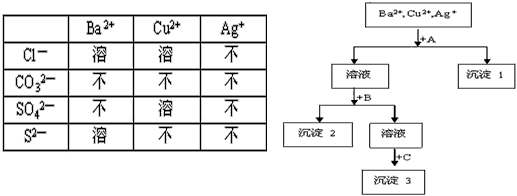
参考答案:(1)AgCl
(2)Ag++Cl-==AgCl↓
(3)硫酸钠溶液
本题解析:
本题难度:一般
3、选择题 下列物质中所含分子物质的量最多的是
A.56 gN2
B.1.5 molO2
C.标准状态下22.4 LCl2
D.3.01×1023个硫酸分子
参考答案:A
本题解析:
本题难度:一般
4、填空题 (14分)工业上SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下: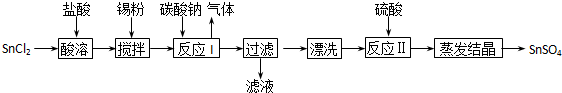
提示:①已知在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式.
②已知Ksp[Sn(OH)2] =1.0×10-26
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是__________,加入Sn粉的作用是_________。
(2)反应I生成的沉淀为SnO,写出该反应的离子方程式___________________________。
(3)检验沉淀已经“漂洗”干净的方法__________________________________________。
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol?L-1,则应控制溶液pH_____。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,请写出发生反应的离子方程式____________。
参考答案:(1)抑制Sn2+水解 (2分) ?防止Sn2+被氧化(2分)(2)Sn2+ + CO32-=SnO↓ + CO2↑(3分)
(3)取最后一次洗涤液,向其中加入AgNO3溶液,若无沉淀,则说明洗涤干净;(2分)
(4)小于1;?(2分)?(5)Sn2+ + H2O2 + 2H+=Sn4+ + 2H2O (3分)
本题解析:(1)SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
(2)反应Ⅰ得到沉淀是SnO,Sn元素化合价没有变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-═SnO↓+CO2↑;
(3)沉淀表面有吸附的氯离子,因此检验沉淀已经“漂洗”干净的方法是:取最后一次洗涤液,向其中加入AgNO3溶液,若无沉淀,则说明洗涤干净;
(4)根据 Ksp[Sn(OH)2]=1.0×10-26=c(OH-)2×c(Sn2+),将c(Sn2+)=1.0mol?L-1带人可得c(OH-)=10-13mol/L,c(H+)=0.1mol/L,故pH小于1,Sn2+完全沉淀;
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O。
本题难度:一般
5、选择题 0.1?mol/L?Na2SO4的溶液中Na+的物质的量浓度
A.0.1mol/L
B.0.2 mol/L
C.0.01 mol/L
D.0.02 mol/L
参考答案:C
本题解析:
本题难度:困难