时间:2017-11-05 23:23:58
1、推断题 A是中学化学中常见无机物,A与NaOH溶液的主要反应关系如图所示,A、B、C中含同一种元素R(不含R的产物已略去)。 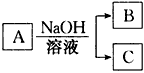
(1)A与NaOH溶液反应,既可只生成B又可只生成C,还可以同时生成B和C。
①若A为氧化物,则A的化学式可能为(写出两种)________、________。
②若A为气态氢化物,B中含有A中两种元素,试写出B与稀硫酸反应生成A 的离子方程式:
____________________。
③若A为一种铝盐,则B、C的化学式分别为________、________。
(2)若A为单质且与NaOH溶液无论以何种物质的量之比反应,产物必为B和C,设R元素在化合物A、B、C中的化合价分别为x、y、z,则x、y、z必须满足的关系是________(写出x、y、z的大小关系)。
参考答案:
(1)①CO2;SO2[或者SO2;CO2];②HS-+H+==H2S↑;③Al(OH)3;NaAlO2[或者NaAlO2;Al(OH)3]
(2)x介于y、z之间(或答:y<x<z、z<x<y)
本题解析:
本题难度:一般
2、推断题 以下一些氧化物和单质之间可发生如下图所示的反应:
其中,氧化物(Ⅰ)是红棕色固体、氧化物(Ⅱ)、(Ⅲ)、(Ⅳ)在反应条件下都是气体。 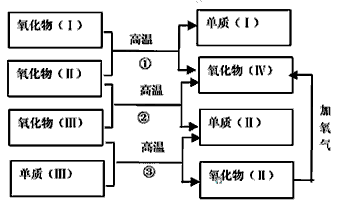
(1)氧化物(Ⅰ)的化学式(分子式)是________。氧化物(Ⅱ)的化学式(分子式)是________。
(2)反应①的化学方程式是__________________。反应②的化学方程式是_______________________。反应③的化学方程式是__________________。
参考答案:(1)?Fe2O3 ;CO?
(2)① Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
② CO+H2O CO2+H2
CO2+H2
③ C+H2O CO+H2 (如写可逆号,同样给分)
CO+H2 (如写可逆号,同样给分)
本题解析:
本题难度:一般
3、推断题 A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示。
请回答:
(1)写出B物质的化学式:_____________;F的化学名称:_______________。
(2)写出第③步反应的离子方程式为_____________________________。
(3)第④步反应中D溶液颜色的变化____________________________;写出第④步反应的离子方程式
__________________。
(4)F溶液中滴入NaOH溶液可能产生的实验现象是_____________________________。
参考答案:(1)Cl2;氯化亚铁
(2)Fe+2H+ ==Fe2++H2↑?
(3)溶液由黄色变为浅绿色;2Fe3++Fe==3Fe2+
(4)先生成灰白色沉淀,立即变成灰绿色,最后变成红裼色
本题解析:
本题难度:一般
4、填空题 (7分)下图中A、B均为固体,其中B为固体单质。下图可用于工业生产液体F,F的消费量常被视为一个国家工业发展水平的标志。回答下列问题:
(1)A由两种元素构成,原子个数比为1:2,D为红棕色固体,A的化学式?
(2)写出D与铝单质反应的化学方程式?
(3)反应②是可逆反应,在2 L的密闭容器中投入4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是?
A.这10分钟内,X的平均速率是0. 1mol/( L·min)
B. 在工业生产中可以通过增加X的量来提高C的转化率
C.当C和X的消耗速率比为2:1时,标志着反应达到平衡
D.平衡时C的转化率是50%
(4)写出标准状况下2.24L气体C与0.15mol氢氧化钠溶液反应的离子方程式?
参考答案:(1)FeS2(1分)?(2)2Al + Fe2O3 2Fe +Al2O3
2Fe +Al2O3
(3)BD?(4)2SO2+3OH- =SO32-+HSO3-+H2O
本题解析:(1)F的消费量常被视为一个国家工业发展水平的标志,所以F是硫酸。则E是SO3,C是SO2,X是氧气,所以B是单质S。又因为D为红棕色固体,因此D是Fe2O3,所以A中含有铁元素。由于A中原子个数比为1:2,所以A是FeS2。
(2)铝能和氧化铁发生铝热反应,方程式为2Al + Fe2O3 2Fe +Al2O3。
2Fe +Al2O3。
(3)考查可逆反应的有关计算,一般采用三段式,即
2SO2?+? O2 2SO3
2SO3
起始量(mol)? 4? 3? 0
转化量(mol)? 2x? x? 2x
平衡量(mol)? 4-2x? 3-x? 2x
则有4-2x+3-x+2x=6mol
解得x=1mol
所以10分钟内氧气的平均速率是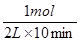 =0.05mol/( L·min),A不正确;SO2的转化率是
=0.05mol/( L·min),A不正确;SO2的转化率是 ,D正确;增大氧气的浓度,平衡向正反应方向移动,可以提高SO2的转化率,B正确;由于反应速率之比是相应的化学计量数之比,所以C和X的消耗速率比总是2:1的,C不正确,答案选BD。
,D正确;增大氧气的浓度,平衡向正反应方向移动,可以提高SO2的转化率,B正确;由于反应速率之比是相应的化学计量数之比,所以C和X的消耗速率比总是2:1的,C不正确,答案选BD。
(4)标准状况下2.24LSO2是0.1mol,氢氧化钠是0.15mol,所以生成物中既有亚硫酸钠,还有亚硫酸氢钠,且二者是1︰1的,因此方程式为2SO2+3OH- =SO32-+HSO3-+H2O。
本题难度:一般
5、填空题 根据反应框图填空,已知反应①~⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120,M为海水中含量最多的无机盐。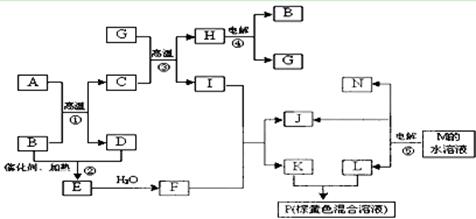
(1)I元素在元素周期表中的位置?;M中阴离子的结构示意图:?。
(2)固体A中所包含的化学键与固体Na2O2类似,则A的电子式为??。
(3)写出下列化学反应的离子方程式:
①溶液P与KSCN溶液:_____________________________________?___;
②G与N的反应:______________________________________ ____ ______;
______;
③K与L的反应:__________________________ _________ _____________。
(4)已知每生成16 gD,放出106.5 kJ热量,则反应①的热化学方程式为:
?
参考答案:(1)第四周期第Ⅷ族;+19 2 8 8 。
(2)? FeS2
(3)写出下列化学反应的离子方程式:
①Fe3+ + 3SCN- = Fe(SCN)3
②2Al + 2OH- +2H2O ="=" 2AlO2- + 3H2
③2Fe2+ + Cl2 ="=" 2Fe3+ + 2Cl-
(4)4FeS2(S) + 11O2(g) ="=" 2Fe2O3(S) + 8SO2(g) ΔH =" -" 3408kl/mol
本题解析:略
本题难度:一般