时间:2017-11-05 23:19:17
1、实验题 (12分)如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化,实验时必须使用铁屑、6 mol/L的硫酸;其他试剂任选。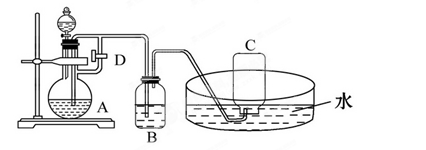
填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中 应预先加入的试剂是________,A中反应的离子方程式为____________________________________________________。
应预先加入的试剂是________,A中反应的离子方程式为____________________________________________________。
(2)实验开始时应先将活塞D_____,其目的是____,在C中收集到的气体主要是_____________________
(3)简述生成Fe(OH)2的操作过程______________________________________________
(4)拔掉装置B中的橡胶塞,使空气进入,写出有关反应的化学方程式________________
参考答案:(1)铁屑?Fe+2H+==Fe2++H2↑
(2)?打开?排除B中的空气?氢气
(3)关闭活塞D,使A中的FeSO4溶液压入B瓶中与NaOH反应,从而制得Fe(OH)2
(4)4Fe(OH)2+O2+2H2O====4Fe(OH)3
本题解析:略
本题难度:一般
2、简答题 三氯化铁是中学化学实验室中常用的化学试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3?6H2O,该同学设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3?6H2O晶体.填写下列空白:
(1)收集导管B处的气体可采用的方法是______.滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是______.
(2)烧杯内放过量稀HNO3的原因是______.发生反应的离子方程式是______.
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是______.
(4)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3?6H2O,而不用直接蒸干的方法来制得晶体的理由是______
(5)你认为该实验存在的缺点可能有:______.
参考答案:(1)导管B处的气体为氢气,氢气密度比空气小且不溶于水,可用排水法或向下排空气法收集;Cu与铁形成Fe-Cu原电池使反应速率加快,
故答案为:用排水法或向下排空气法;因废铁屑中含少量Cu等杂质,形成Fe-Cu原电池使反应速率加快;
(2)过量的稀HNO3保证使Fe2+ 全部氧化成Fe3+;反应的离子方程式是3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,
故答案为:稀HNO3有强氧化性,为保证使Fe2+全部氧化成Fe3+;3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
(3)使分液漏斗中的酸可滴入A中,故答案为:与大气相通,使分液漏斗中的酸可滴入A中;
(4)因为FeCl3是强酸弱碱盐水解,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3?6H2O,
故答案为:因为FeCl3是强酸弱碱盐水FeCl3+3H2O?Fe(OH)3+3HCl,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3?6H2O;
(5)无尾气处理装置,用稀HNO3氧化FeCl2时会引入硝酸根离子使制得的FeCl3?6H2O不纯,
故答案为:反应中产生的有害气体会污染环境;用稀HNO3氧化FeCl2时会有Fe(NO3)3生成而使制得的FeCl3?6H2O不纯;
本题解析:
本题难度:一般
3、填空题
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A发生铝热反应,产物中有单质B生成,
②另取20 g A全部溶于0.15 L 6.0mol/L的盐酸中,得溶液C,
③将①中得到的单质B和溶液C反应,放出1.12 L(标准状况)气体,同时生成溶液D,还残留有固体物质B,
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是_________,产物中的单质B是____________。
(2)②中所发生的各反应的化学方程式是_______________________________
(3)③中所发生的各反应的离子方程式是_______________________________
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为_________,c(Fe2+)为_________。
参考答案:(1)插上Mg条并将其点燃;Fe
(2)Fe2O3+6HCl = 2FeCl3+3H2O;MgO+2HCl = MgCl2+H2O
(3)Fe+2H+ = Fe2++H2↑;Fe+2Fe3+ = 3Fe2+
(4)0.67 mol/L;2.3 mol/L
本题解析:
本题难度:一般
4、选择题 下表中,对陈述I、II的正确性及其有无因果关系的判断都正确的是
| 选项 | 陈述I | 陈述II | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | I对;II对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁生成铁 | I对;II对;无 |
| C | 铁属于过渡金属元素 | 铁和铁的某些化合物可以用作催化剂 | I错;II对;无 |
| D | 铁在空气中表面生成致密氧化膜 | 可用铁罐储存运输浓硫酸、浓硝酸 | I对;II对;有 参考答案:B 本题解析:铝是地壳中含量最高的金属元素,铜是人类最早使用的金属材料,选项A不正确;过渡元素常用作催化剂,因此选项C中有因果关系,C不正确;铁在空气中表面不能生成致密氧化膜,所以选项D不正确,答案选B。 本题难度:一般 5、实验题 (14分)FeSO4·7H2O广泛用于医药和工业领域,以下是FeSO4·7H2O的实验室制备流程图。根据题意完成下列填空: |
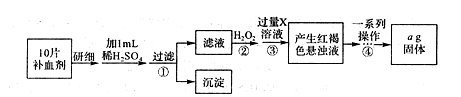
参考答案:(1)除去废铁屑表面的油污(1分),倾倒法(1分) (2)趁热过滤(2分)
(3)减少洗涤过程中FeSO4·7H2O的损耗(2分)
(4)I.100ml容量瓶、胶头滴管(2分) BD(2分)
Ⅱ.①灼烧(1分) ②0.07a(2分) ③偏小(1分)
本题解析:(1)CO32-水解生成OH-,溶液显碱性,酯在碱性条件下完全水解,所以可用纯碱溶液除油污。铁是不溶于水的金属,要分离铁可以直接倾倒法。
(2)根据硫酸亚铁溶液的后续操作是冷却结晶可知,操作a应该是趁热过滤得到硫酸亚铁溶液。
(3)由于硫酸亚铁的溶解度随温度的升高二增大,因此用冰水洗涤的另一个目的是减少洗涤过程中FeSO4·7H2O的损耗。
I.(4)100mL 1.00×10 - 2 mol·L-1的KMnO4溶液时,所用的仪器有天平、药匙、烧杯、玻璃棒,还需要有100ml容量瓶、胶头滴管;A、配制任何溶液都不能在容量瓶中溶解溶质,A不正确;B、由于容量瓶中含有蒸馏水对实验结果不会造成影响,所以容量瓶洗涤后不需干燥即可直接用于实验,B正确;C、定容后摇匀,凹液面低于刻度线,再加水至凹液面最低点与刻度线相平,则容量瓶中溶液的体积增加,浓度偏低,C不正确;D、如果定容时加水超过刻度线必须重新配制,D正确,答案选BD。
Ⅱ.①步骤④最终得到氧化铁固体,所以其过程为过滤、洗涤、灼烧、冷却、称量、恒重.故答案为:灼烧;
②agFe2O3中Fe元素质量为:ag×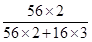 =0.7ag,由铁元素守恒,1片补血剂中铁元素质量为0.07ag,故答案为:0.07a。
=0.7ag,由铁元素守恒,1片补血剂中铁元素质量为0.07ag,故答案为:0.07a。
③若步骤③加入X溶液的量不足,则导致溶液中铁离子不能完全转化为氢氧化铁,因此最后测出每片补血剂含铁元素的质量将偏小。
本题难度:困难