时间:2017-11-05 23:15:22
1、填空题 写出下列物质的电子式:
(1)、MgCl2______?(2)、N2______? (3)、Br2______?(4)、CH4______.
参考答案:(1)镁失去2个电子形成阳离子,氯原子得到电子形成阴离子,电子式为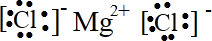
,
故答案为: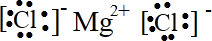
;
2)氮原子间形成三对共用电子对,电子式为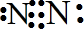
,
故答案为: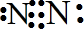
;
(3)溴最外层有7个电子,形成一对共用电子对,电子式为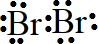
,
故答案为: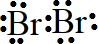
;
(4)碳原子最外层的4个电子分别与氢原子形成共用电子对,电子式为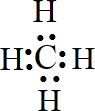
,
故答案为: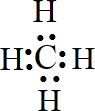
.
本题解析:
本题难度:一般
2、简答题 2005年诺贝尔化学奖授予三位在绿色化学领域有突出成就的科学家,绿色化学核心是实现零排放,而加成反应和化合反应实现了零排放.重氮甲烷在有机合成中有重要应用,可以用来合成甲醚、羧酸、酯类等重要有机产物.重氮甲烷的分子结构可以表示为?CH2-N≡N,在其分子中,碳原子和氮原子之间的共用电子对是由氮原子一方提供的.
(1)重氮甲烷的电子式为______.
(2)重氮甲烷在受热或光照时容易分解放出氮气,同时生成一个极活泼的缺电子基团亚甲基或称为碳烯(:CH2).碳烯是一个反应中间产物,只能在反应中短暂存在,大约只能存在一秒钟.碳烯的电子式是______.
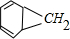
(3)碳烯很容易与烯烃、炔烃发生加成反应,生成三元环状化合物.碳烯与丙烯发生加成反应后所得产物的结构简式为______.
(4)碳烯还可以插入到C-H键,C-C键之间,使碳链加长,当它插入丙烷分子中C-H键之间,碳链增长后的化合物的结构简式为______或______.
(5)请分别写出碳烯与2-丁烯、苯反应的化学方程式(有机物用结构简式表示):
①______;
②______.
参考答案:(1)重氮甲烷分子中,碳原子和氮原子之间的共用电子对是由氮原子一方提供的,重氮甲烷的分子结构为CH2-N≡N,
将共价键换成电子对,且最外边的N原子含有一个孤电子对,所以其电子式为: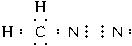
,故答案为: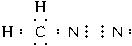
;
(2)将共价键换成电子对,且亚甲基含有一个孤电子对,所以其电子式为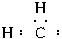
,故答案为: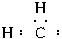
;
(3)发生加成时,碳碳双键打开,亚甲基和两个半键相连形成环状烃,所以碳烯与丙烯发生加成反应后生成1-甲基环丙烷,所以其结构简式为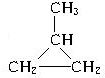
,故答案为
;
(4)碳烯插入丙烷分子中C-H键之间时,可能是甲基上的C-H键之间,也可能是中间碳原子上的C-H键之间,如果在甲基C-H键之间,则生成物的结构简式为:CH3CH2CH2CH3,如果是在亚甲基碳原子上的C-H键之间插入,则生成物的结构简式为CH3CH(CH3)2,故答案为:CH3CH2CH2CH3,CH3CH(CH3)2;
(5)生加成时,碳碳双键打开,亚甲基和两个半键相连形成环状烃,所以碳烯和2-丁烯反应的方程式为: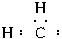
+CH3CH=CHCH3→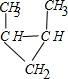
,
苯和碳烯的反应方程式为: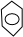
+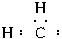
→
,
故答案为: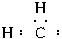
+CH3CH=CHCH3→
,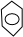
+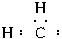
→
.
本题解析:
本题难度:一般
3、选择题 下列说法不正确的是
[? ]
A.CuSO4·5H2O是化合物
B.钙离子的电子式是Ca2+
C.SO2与O2反应生成SO3,说明SO2具有可燃性
D.CO2是具有极性键的直线形分子
参考答案:C
本题解析:
本题难度:简单
4、填空题 (1) 在下列化合物中:H2O2?、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
在下列化合物中:H2O2?、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题: 只由非金属组成的离子化合物是?,
只由非金属组成的离子化合物是?,
只有极性共价键的共价化合物是?, 只含有非极性共价键的是?,
只含有非极性共价键的是?,
既有离子键又有非极性键的化合物是?。
(2)在下列物质中,①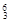 Li? ②
Li? ②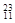 Na? ③
Na? ③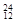 Mg? ④
Mg? ④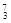 Li? ⑤
Li? ⑤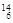 C? ⑥C60?⑦石墨,为同位素的是?,互为同素异形体的是??。(填编号)
C? ⑥C60?⑦石墨,为同位素的是?,互为同素异形体的是??。(填编号)
参考答案:①NH4Cl;?②CO2;?③I2 ;?④Na2O2.?(2)①④,⑥⑦
本题解析:(1)只由非金属组成的离子化合物是NH4Cl;只有极性共价键的共价化合物是CO2;只含有非极性共价键的是I2;既有离子键又有非极性键的化合物是Na2O2;(2)在①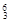 Li? ②
Li? ②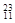 Na? ③
Na? ③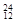 Mg? ④
Mg? ④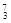 Li? ⑤
Li? ⑤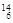 C? ⑥C60?⑦石墨,为同位素的是①④,同素异形体的是⑥⑦。
C? ⑥C60?⑦石墨,为同位素的是①④,同素异形体的是⑥⑦。
点评:本题考查了化学键、同位素、同素异形体的基础知识,该题比较简单。
本题难度:一般
5、填空题 已知元素A、B、C、D、E、F均属前四周期,且原子序数依次增大, A的p能级电子数是s能级电子数的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能级层均排满,且最外层电子数为1。请回答下列问题:
(1)C原子基态时的电子排布式为?。?
(2)B、C两种元素第一电离能为:?﹥?(用元素符号表示)。
试解释其原因: ?。
(3)任写一种与AB- ?离子互为等电子体的微粒?。
(4)B与C形成的四原子阴离子的立体构型为?,其中B原子的杂化类型是?。
(5)D和E形成的化合物的晶胞结构如图,其化学式为?,E的配位数是?;已知晶体的密度为? ρ g·cm-3,阿伏加德罗常数为NA,则晶胞边长a=?cm.(用含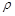 、NA的计算式表示)
、NA的计算式表示)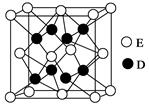
参考答案:(1)1s22s22p4;(2)N>O;氮原子核外2p亚层处于半充满的较稳定结构,不易失去电子,故第一电离能比氧原子大;(3)CO或C22- 或O22+;(4)平面三角形,sp2;(5)CaF2,8,?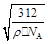 。
。
本题解析:根据题意知,元素A、B、C、D、E、F均属前四周期,且原子序数依次增大, A的p能级电子数是s能级电子数的一半,A的原子核外电子排布式为1s22s22p2,则A为碳元素;C的基态原子2p轨道有2个未成对电子,C的原子核外电子排布式为1s22s22p4,则C为氧元素;又A、B、 C原子序数依次增大,则B为氮元素;C与D形成的化合物中C显正化合价,则D为氟元素;E的M层电子数是N层电子数的4倍,则E为钙元素;F的内部各能级层均排满,且最外层电子数为1,则F为铜元素。(1)C为氧元素,原子基态时的电子排布式为1s22s22p4;(2)B为氮元素,C为氧元素,氮原子核外2p亚层处于半充满的较稳定结构,不易失去电子,两种元素第一电离能为N>O;(3)根据等电子体概念知,与CN-离子互为等电子体的微粒为CO或C22- 或O22+;(4)根据价层电子对互斥理论判断,B与C形成的四原子阴离子NO3—的立体构型为平面三角形,其中B原子的杂化类型是sp2;(5)利用切割法结合化合物的晶胞判断,其化学式为CaF2,E的配位数是8;由化合物CaF2的晶胞结构可知,1个晶胞中含有钙离子数目为8×1/8+6×1/2=4,含有氟离子数目为8,所以1mol晶胞的质量为312g,又晶体的密度为ρ g·cm-3,则1个晶胞的体积312/ρNAcm3,则晶胞边长a=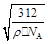 cm。
cm。
本题难度:一般