时间:2017-11-05 23:14:37
1、选择题 用铂电极电解CuSO4溶液,当溶液中Cu2+浓度降至一定范围时,需加入适量的物质。如果要使加入物质后溶液的浓度和体积恢复到电解前的状况,所加入的物质是?
A.CuSO4
B.CuSO4·5H2O
C.CuO
D.Cu(OH)2
参考答案:C
本题解析:用惰性电极电解CuSO4溶液,反应
阴极:2Cu2++4e==2Cu
阳极:4OH--4e==O2↑+2H2O
总反应式:
2CuSO4+2H2O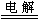 2Cu+2H2SO4+O2↑
2Cu+2H2SO4+O2↑
电解的结果,除了在阴极得到Cu,在阳极放出O2之外,溶液中H+浓度增大,产生了H2SO4。因此,要使溶液恢复到原来状况,除了要补充Cu2+,还得中和掉H+。由此可知,单纯加入CuSO4或CuSO4·5H2O是不行的,而加入CuO或Cu(OH)2则可达到上述目的。但需要溶液的浓度和体积不变,加入Cu(OH)2会多生成H2O出来,所以选CuO。
本题难度:一般
2、填空题 如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有饱和NaCl溶液。
①甲中石墨棒上的电极反应式为?;
②乙中总反应的离子方程式为?;
③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为:?;
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为:?;
②如果起始时乙中盛有200 mL pH = 5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入?(填写物质的化学式)?g。
参考答案:(1)①O2+2H2O+4e-=4OH-
②2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
③5Cl2+I2+6H2O=10HCl+2HIO3
(2)①Fe-2e-=Fe2+
②CuO(或CuCO3)? 0.8(或1.24)
本题解析:(1)若两烧杯中均盛有饱和NaCl溶液,则:
①甲装置为原电池,石墨棒作正极,O2放电,电极反应为:O2+2H2O+4e-=4OH-。
②乙装置为电解池,石墨棒上发生氧化反应,Fe电极不参与反应,其实质与用惰性电极电解食盐水相同,离子方程式为:2Cl-+2H2O Cl2↑+H2↑+2OH-。③Cl2和I2的物质的量之比为5∶1,生成HCl和HIO3。
Cl2↑+H2↑+2OH-。③Cl2和I2的物质的量之比为5∶1,生成HCl和HIO3。
(2)若两烧杯中均盛有CuSO4溶液,则:①甲装置为原电池,铁作负极,电极反应式为:Fe-2e-=Fe2+。②乙装置为电解池,电解反应为:2CuSO4+2H2O 2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态。由电解反应式可知,2H+~CuO~CuCO3,电解后n(H+)=" 0.1×0.2" = 0.02(mol),故m(CuO)=0.02×
2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态。由电解反应式可知,2H+~CuO~CuCO3,电解后n(H+)=" 0.1×0.2" = 0.02(mol),故m(CuO)=0.02× ×80 = 0.8(g),m(CuCO3)=0.02×
×80 = 0.8(g),m(CuCO3)=0.02× ×124=1.24(g)
×124=1.24(g)
本题难度:一般
3、填空题 从H+、K+、Cu2+、Cl-、SO42-中选取适当的离子组成符合下列情况的电解质,进行电解(阳离子只能使用一次)。
(1)以碳棒为电极进行电解,电解质的含量减少,水量保持不变,两极都有气体生成,气体体积相同,则该电解质的化学式为____________,电解的电极反应____________,电解的总方程式是__________________________________。
(2)以铂丝为电极进行电解,水量减少,电解质的含量保持不变,两极都有气体生成,气体体积比为2:1,则该电解质的化学式为____________________,电极反应式为____________________。
(3)惰性电解,电解质的含量减少,水的含量也减少,pH下降,则电解质的化学式为____________,电解的总方程式为__________________________________。
参考答案:(1)HCl;阴极:2H++2e-==H2↑;阳极:2Cl--2e-==Cl2↑;2HCl H2↑+Cl2↑
H2↑+Cl2↑
(2)K2SO4;阴极:4H++4e-==2H2↑、阳极:4OH--4e-==2H2O+O2↑
(3)CuSO4;2CuSO4+2H2O 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
本题解析:
本题难度:一般
4、填空题 (10分)图示的四个容器中分别盛有不同的溶液,除A、B外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4 2PbSO4+2H2O,其两个电极的电极材料分别是PbO2和Pb。
2PbSO4+2H2O,其两个电极的电极材料分别是PbO2和Pb。
闭合S,发现G电极附近的溶液变红,20 min后,将S断开,此时C、D两极上产生的气体体积相同;据此回答:
(1)A电极的电极材料是______________(填“PbO2”或“Pb”)。
(2)电解后,要使丙中溶液恢复到原来的浓度,需加入的物质是________(填化学式)。
(3)到20 min时,电路中通过电子的物质的量为________。
(4)0~20 min,H电极上发生反应的电极反应式为______________
参考答案:28(1)PbO2 (2) H2O (3)0.4mol; (4)2Cl--2e-=Cl2↑;4OH--4e-=O2+2H2O
本题解析:(1)闭合S,发现G电极附近的溶液变红,说明G的电极反应为2H2O+2e-=H2+2OH-,G为阴极,则H为阳极,A为正极,A电极的电极材料是PbO2;(2)丙中电解硫酸铝溶液,实际上是电解水,要使丙中溶液恢复到原来的浓度,需加入的物质是水;(3)20 min后,将S断开,此时C、D两极上产生的气体体积相同,设C、D产生气体的物质的量为xmol,
C极发生的电极反应为Cu2+ + 2e- =" Cu" 、2H+ + 2e- = H2↑,D极的电极反应为4OH— - 4e- = 2H2O + O2↑
0.1 0.2 2x x 4x x
0.2+2x="4x" 解得x="0.1" 则到20 min时,电路中通过电子的物质的量为0.4mol;
(4)0~20 min,H电极上发生反应的电极反应式为2Cl--2e-=Cl2↑;0.2moLCl-只放电0.2moL,随后是OH-放电,即4OH--4e-=O2+2H2O 。
考点:考查铅蓄电池,电解原理的应用。
本题难度:一般
5、填空题 (9分)下图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(1)N的电极反应式为 :
乙池的总化学方程式是 ,
加入甲烷的铂电极的电极反应式为 。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为 L(标准状况下);若此时乙池溶液的体积为200mL,则乙池中溶液的H+的浓度为 。
参考答案:(1)4OH--4e-=O2↑+2H2O(1分);
4AgNO3+2H2O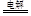 4Ag+4HNO3+2O2↑(2分);
4Ag+4HNO3+2O2↑(2分);
CH4-8e-+10OH-=CO32-+7H2O(2分)
(2)0.224(2分);0.2mol/L(2分)
本题解析:(1)甲池是以氢氧化钾溶液为电解液的甲烷燃料电池,通入甲烷的一极为原电池的负极,电极反应式为:CH4-8e-+10OH-=CO32-+7H2O,通入氧气的一极为原电池的正极,电极反应式为:O2 + 2H2O + 4e-=4OH-;乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,为电解池的阳极,应为石墨材料,N为阳极,电极反应式是4OH--4e-=O2↑+2H2O,M为阴极,电极反应式为Ag++e-=Ag,电解的总反应为:4AgNO3+2H2O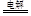 4Ag+4HNO3+2O2↑;(2)n(Ag)=0.04mol,根据Ag++e-=Ag可知转移电子为0.04mol,甲池中通入氧气的一极为正极,电极反应式为:O2 + 2H2O + 4e- = 4OH-,则消耗n(O2)=0.01mol,
4Ag+4HNO3+2O2↑;(2)n(Ag)=0.04mol,根据Ag++e-=Ag可知转移电子为0.04mol,甲池中通入氧气的一极为正极,电极反应式为:O2 + 2H2O + 4e- = 4OH-,则消耗n(O2)=0.01mol,
V(O2)=0.224L;根据反应4AgNO3+2H2O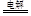 4Ag+4HNO3+2O2↑知,n(H+)=n(HNO3)=0.04mol,又溶液的体积为200mL,则c(H+)=0.2mol/L。
4Ag+4HNO3+2O2↑知,n(H+)=n(HNO3)=0.04mol,又溶液的体积为200mL,则c(H+)=0.2mol/L。
考点:考查原电池原理、燃料电池及电解原理的应用。
本题难度:困难