时间:2017-11-05 23:13:35
1、填空题 (10分)如图为相互串联的甲乙两个电解池,请回答:
甲池若为用电解精炼铜的装置:
(1)A极电极反应为 ,
B极电极反应为_ _,
乙池中的总反应离子方程式为 。
(2)若甲槽阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为 。
(3)若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为 。
参考答案:(10分) (1) Cu2+ + 2e
本题解析:
本题难度:一般
2、填空题 (三选一)【化学与技术】
下表列出了3种燃煤烟气脱硫方法的原理。 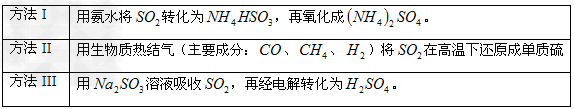
(1)光谱研究表明,易溶于水的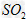 所形成的溶液中存在着下列平衡
所形成的溶液中存在着下列平衡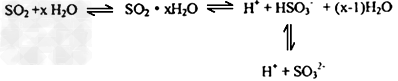
据此,下列判断中正确的是______________。
A.?该溶液中存在着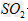 分子
分子
B.?该溶液中H+浓度是SO32-浓度的2倍
C.?向该溶液中加入任何足量的强酸都能放出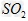 气体
气体
D.?向该溶液中加入过量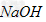 可得到
可得到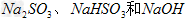 的混合溶液
的混合溶液
(2)方法I中用氨水吸收燃煤烟气中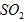 的离子方程式为______________。能提高燃煤烟气中
的离子方程式为______________。能提高燃煤烟气中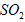 去除率的措施有______________(填字母)
去除率的措施有______________(填字母)
A.?增大氨水浓度 B.?升高反应温度
C.?使燃煤烟气与氨水充分接触 D.?通入空气使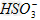 转化为
转化为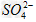 ?
?
采用方法I脱硫,并不需要先除去燃煤烟气中大量的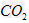 ,原因是(用离子方程式表示)_______________________________。
,原因是(用离子方程式表示)_______________________________。
(3)方法II主要发生了下列反应: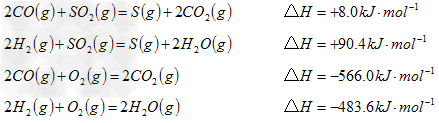
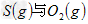 反应生成
反应生成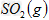 的热化学方程式为___________________。
的热化学方程式为___________________。
(4)方法III中用惰性电极电解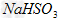 溶液的装置如下图所示(阴离子交换膜只允许阴离子通过)。阳极区放出的气体的成分为_____________(填化学式)。
溶液的装置如下图所示(阴离子交换膜只允许阴离子通过)。阳极区放出的气体的成分为_____________(填化学式)。 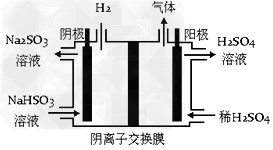
参考答案:(1)A ?
(2)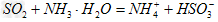 ;ACD;
;ACD;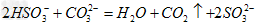 ?
?
(3) ?
?
(4)
本题解析:
本题难度:一般
3、选择题 用含少量银和锌的粗铜做阳极,纯铜片做阴极,CuSO4溶液做电解液,电解一段时间后,阳极质量减少了x g,则
[? ]
A.电解液质量增加x g
B.阴极质量增加x g
C.阴极质量增加a g,a>x
D.阴极质量增加b g,b<x
参考答案:D
本题解析:
本题难度:一般
4、选择题 用石墨电极电解氯化铜溶液,通电的电流为 aA,在 b min时,测得阴极质量增加 c g;阳极得到 X L纯净气体(设无损失,体积为标准状况时的体积),已知1个电子的电荷量为YC(库仑),铜的相对原子质量为64,</PGN0020B.TXT/PGN>则由以上实验测得阿伏加德罗常数NA的计算式表示正确的是?

参考答案:C
本题解析: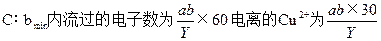
个,质量为c克,即c/64mol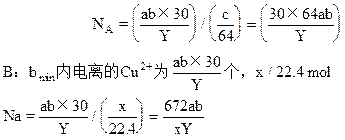
本题难度:一般
5、填空题 全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大。
Ⅰ.(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
Ⅱ.SO2和NOx都是大气污染物。
(3)空气中的NO2可形成硝酸型酸雨,该反应的化学方程式是
(4)利用氨水可以将SO2和NO2吸收,原理如下图所示:
NO2被吸收的离子方程式是 。
(5)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
①a为电源的 (填“正极”或“负极”),阳极的电极反应式为 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为 。
(6)工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g);△H<0,一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,则下列说法正确的是 。
2SO3(g);△H<0,一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,则下列说法正确的是 。
A.若反应速率v(SO2)=v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.保持温度和容器体积不变,平衡后再充入2molSO3,再次平衡时各组分浓度均比原平衡时的浓度大
F.平衡后升高温度,平衡常数K增大
参考答案:(1)BD (2)CH4(g)+N2O4(g) N2(g)+CO2(g)+2H2O(l) △H=-898.1kJ/mol
N2(g)+CO2(g)+2H2O(l) △H=-898.1kJ/mol
(3)3NO2+H2O=2HNO3+NO (4)4HSO3- + 2NO2=N2+4SO42- + 4H+
(5)正极、SO2-2e- +2H2O =SO42- + 4H+ 1:2 (6)D
本题解析:(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。则A、根据图像可知t1时正反应速率仍然在变化,说明没有达到平衡状态,A错误;B、根据图像可知t1时平衡常数不再变化,正逆反应速率相等,说明达到了平衡状态,B正确;C、根据图像可知t1时二氧化碳和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,C错误;D、根据图像可知t1时一氧化氮的质量分数不再变化,表明正逆反应速率相等,达到了平衡状态,D正确,答案选BD;
(2)已知:CH4(g)+2NO2(g)
本题难度:困难