时间:2017-11-05 23:04:52
1、选择题 关于常温下pH=2的醋酸溶液,下列叙述正确的是
A.c(CH3COOH)=0.01mol·L-1
B.c(H+)=c(CH3COO-)
C.加水稀释100倍后,溶液pH=4
D.醋酸的电离常数为Ka,CH3COO-的水解常数为Kh,则Ka·Kh=Kw
参考答案:D
本题解析:醋酸部分电离,它的起始物质的量浓度比c(H+)大得多,A错;由于水也电离出H+,c(H+)>c(CH3COO-)B错;加水稀释100倍,pH上升不到2个单位,C错。Kh=c(OH-)(CH3COOH)/c(CH3COO-),给表达式上下同乘以c(H+),方可推断出Ka·Kh=Kw。答案选D。
本题难度:一般
2、选择题 下列有关电解质溶液中微粒的物质的量浓度关系正确的是(?)
A.在0.1 mol·L-1NaHCO3溶液中:c(Na+) >c(OH-)>c(HCO3-) >c(H+)
B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(Na+) -c(HCO3-)
C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(Na+)+c(H+) =c(OH-) +c(HCO3-) +c(CO32-)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]: c(CH3COO-) =0.1 mol·L-1
参考答案:D
本题解析:HCO3-的水解程度或电离程度均是很小的,A不正确,应该是c(Na+) >c(HCO3-) >c(OH-) >c(H+);根据电荷守恒可知,c(Na+)+c(H+) =c(OH-) +c(HCO3-) +2c(CO32-),因此选项BC 都是错误的;同样根据电荷守恒可知,D正确,答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型与重要的考点。试题在注重对基础知识巩固与训练的同时,侧重对学生能力的培养。该题的关键是利用好几个守恒关系,即电荷守恒、物料守恒和质子守恒,并能结合同样灵活运用。
本题难度:简单
3、选择题 氢气是未来的理想能源,理由是(? )。
①热值高 ②燃烧时不污染环境? ③用于制取H2的水资源丰富? ④密度小,便于运输
A.①②③
B.②③④
C.①③④
D.①②③④
参考答案:A
本题解析:氢气的密度小,但氢气是气体且属于可燃性气体,不便于运输和储存,所以选项④不正确,其余选项都是正确的,答案选A。
点评:新能源是相对于常规能源说的,一般具有资源丰富、可以再生,没有污染或很少污染等。常见的新能源有太阳能、风能、生物质能、氢能、地热能和潮汐能等许多种。
本题难度:简单
4、实验题 (9分)用中和滴定法测定某烧碱的浓度。请回答在主要操作过程中的有关问题:
(1)将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液。将0.20mol/L的盐酸标准溶液装入酸式滴定管,滴定时,锥形瓶中加2—3滴?作为指示剂;滴定过程中,左手控制活塞,右手旋转摇动锥形瓶,眼睛应注视?,
当?时即为滴定终点。有关数据如下:
| 滴定序号 | 待测溶液体积(单位:mL) | 所消耗盐酸体积(单位:mL) | ||
| 滴定前读数 | 滴定后读数 | 消耗盐酸体积 | ||
| 1 | 20.00 | 0.50 | 20.60 | V(平)= ________ |
| 2 | 20.00 | 6.00 | 26.00 | |
参考答案:(9分)(1)酚酞或甲基橙?;?锥形瓶内溶液颜色变化?;?当溶液突然由红色变为无色(或黄色变为橙色),且30秒后颜色不恢复;?(各1分,共3分)
(2)0.20 (0.2也给分)(1分)? 94.12%?(2分)?(3) A? B? D(3分)
本题解析:略
本题难度:一般
5、计算题 (8分) 25℃时,若体积为Va、pH=a 的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va>Vb和a=0.5b。则:
(1) a值可否等于3 (填“可”或“否”)?,其理由是?。
(2) a值可否等于5(填“可”或“否”)?,其理由是?。
(3)a 的取值范围?。
参考答案:)(1)否,a=0.5b时,若a=3,b=6,不合题意;
(2)可,若a=5,则b=10,强酸中c(H+)=10-5 ?mol·L-1,强碱中c(OH-)=10-4? mol·L-1,根据恰好中和可得10-5 mol·L-1Va=10-4 mol·L-1Vb,Va / Vb=10>1,符合。? (3) 14/3<a<7
本题解析:考查溶液pH计算。
(1)若a=3,则b=6,25℃是碱溶液的pH应该是大于7的,所以a不可能等于3。
(2)若a=5,则b=10,强酸中c(H+)=10-5 ?mol·L-1,强碱中c(OH-)=10-4? mol·L-1,根据恰好中和可得10-5 mol·L-1Va=10-4 mol·L-1Vb,Va / Vb=10 >1,所以符合条件。
(3)由于b<14,所以a<7。因为恰好反应,所以10-a mol·L-1Va=10b-14 mol·L-1Vb,解得Va / Vb=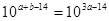 >1,解得a>14/3。所以a的取值范围是14/3<a<7。
>1,解得a>14/3。所以a的取值范围是14/3<a<7。
本题难度:一般