时间:2017-11-05 23:04:52
1、填空题 (共7分)工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g)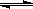 CH3OH(g)。图1表示反应中的能量变化;请回答下列问题:
CH3OH(g)。图1表示反应中的能量变化;请回答下列问题: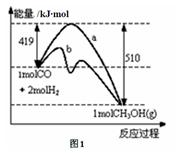
(1)在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g)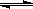 CH3OH(g)的△H = 。
CH3OH(g)的△H = 。
(2)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)ΔH =-193kJ/mol,又知H2O(l)= H2O(g) ΔH =+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
参考答案:(1)b —91KJ/mol
(2)CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-281kJ/mol
本题解析:(1) 催化剂降低反应的活化能,所以b使用了催化剂;△H =生成物的总能量—反应物的总能量="—91" kJ/mol;(2) ①CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)ΔH =-193kJ/mol,②H2O(l)= H2O(g) ΔH =+44 kJ/mol,根据盖斯定律,①-②×2得:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-281kJ/mol。
考点:本题考查反应热。
本题难度:一般
2、选择题 下列叙述中正确的是?
A.Zn和PH = 3的醋酸反应比和 PH =" 4" 的硫酸溶液反应更缓慢
B.c(H+) = 10-3 mol/L 的强酸溶液和 c(OH-) = 10-3 mol/L 的弱碱溶液等体积混合后, 溶液呈酸性
C.PH 值相等, 体积也相等的硝酸和硫酸溶液中, H+的物质的量也相等
D.中和 10mL 0.1mol/L 的氨水与中和 100mL 0.01mol/L 的氨水所需要同一酸液的量不同
参考答案:C
本题解析:A中pH越小,氢离子浓度越大,反应速率越快,A不正确;B中弱碱的浓度一定大于0.001mol/L,则弱碱是过量的,溶液性碱性,B不正确;C正确,D中氨水的物质的量是相同的,消耗酸的量是相同的,D不正确,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,在注重对学生基础知识巩固和检验的同时,侧重对学生解题能力的培养,有利于培养学生的逻辑推理能力和灵活应变能力。该题的关键是明确酸碱中和的原理,以及溶液酸碱性的判断依据。
本题难度:一般
3、选择题 目前人类正在研究发展从海底开采可燃冰(CH4?nH2O)的技术,以解决能源问题。下列有关说法错误的是
A.可燃冰是分子晶体,熔沸点低
B.CH4分子结构是对称的
C.H2O是非极性分子
D.使用可燃冰替代煤和石油,可以解决酸雨问题
参考答案:C
本题解析:根据可燃冰的分子组成可知,该物质形成的晶体是分子晶体,A正确;甲烷是正四面体型结构,属于非极性分子,B正确。但水是V形结构,是极性分子,C不正确,甲烷的燃烧产物是CO2,不会形成酸雨,D正确,答案选C。
点评:该题是基础性知识的考查,试题结合当今热点,起点高,落点低,有利于调动学生的学习兴趣,激发学生学习化学的积极性,也有助于培养学生的环境保护意识。
本题难度:一般
4、选择题 在某温度时,测得纯水中的c(H+)=2.0×10-7 mol·L-1,则c( OH-)为
OH-)为
A.2.0×10-7 mol·L-1
B.0.1×10-7 mol·L-1
C.1.0×10-14/2.0×10-7 mol·L-1
D.无法确定
参考答案:A
本题解析:略
本题难度:简单
5、选择题 下列属于化石燃料的是
A.氢气
B.木柴
C.煤
D.酒精
参考答案:C
本题解析:化石燃料包括煤、石油、天然气,所以属于化石燃料的是煤,答案选C。
考点:考查化石燃料的判断
本题难度:简单