时间:2017-11-05 22:55:10
1、计算题 (6分)现有一种铜和铁的混合物样品。为测定该样品中铁的含量,某学生取10.0 g此样品置于烧瓶中,将80.0 mL稀硫酸分四次加入烧瓶并做相关记录。
有关数据记录如下表:
| 加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 7.20 |
| 2 | 20.0 | 4.40 |
| 3 | 20.0 | 2.00 |
| 4 | 20.0 | 2.00 |
参考答案:(1)80%?(2)2.5mol/L
本题解析:(1)根据表中数据可知,最后剩余铜2 g,则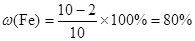
(2) Fe? +? H2SO4? =" Fe" SO4 + H2↑
56g? 1mol
2.8g?c(H2SO4)×0.02L
所用硫酸溶液溶质的物质的量浓度c (H2SO4)=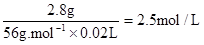
点评:本题主要考查学生的分析能力,很简单基础。
本题难度:一般
2、选择题 把表面有氧化物的相同大小的铜片和铁片一起放入盐酸中充分反应,所得溶液中的金属离子
A.是Fe3+和Cu2+
B.是Fe2+和Cu2+
C.是Fe2+和Fe3+
D.只有Fe2+
参考答案:D
本题解析:表面的氧化物的量较少,溶于盐酸后,生成的Cu2+和Fe3+也较少,分别被单质铁还原为Cu和Fe2+,铜与盐酸不反应,铁与盐酸反应生成Fe2+。
本题难度:简单
3、实验题 现有一份含有FeCl3和FeCl2的固体混合物,为测定各成分的含量进行如下两个实验:
实验1
①称取一定质量的样品,将样品溶解;
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;
③将沉淀过滤、洗涤、干燥得到白色固体17.22 g。
实验2
①称取与实验1中相同质量的样品,将样品溶解;
②向溶解后的溶液中,通入足量的Cl2;
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀;
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4 g。
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有_____________________________。
(2)实验室保存FeCl2溶液时通常会向其中加入少量试剂______________和____________。
(3)实验2通入足量Cl2的目的是________________________________;涉及的化学反应的离子方程式是______________________________。
(4)检验实验2的步骤④中沉淀已经洗涤干净的方法是_________________________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)。________________________________________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及胶体的特性。以下关于胶体的说法不正确的是________________。
A.胶体粒子能透过滤纸,但不能透过半透膜
B.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C.只有胶体粒子能做布朗运动
D.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
E.在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算固体样品中FeCl3和FeCl2的物质的量之比为________________。
(8)可以采用下列装置制取少量的FeCl3固体,已知FeCl3易潮解。(部分夹持仪器已略去)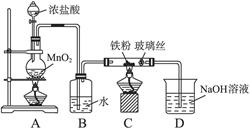
该装置存在不足,往往无法得到FeCl3固体,请你对装置提出合理的改进措施。___________。
参考答案:(1)烧杯、玻璃棒
(2)稀盐酸铁粉
(3)将Fe2+全部转化为Fe3+ 2Fe2++Cl2====2Fe3++2Cl-
(4)向洗涤后的溶液中滴加少量硝酸酸化的硝酸银溶液,如果没有白色沉淀生成,说明沉淀已经洗涤干净
(5)FeCl3在水中存在如下平衡 FeCl3+3H2O Fe(OH)3+3HCl,在加热条件下,由于HCl易挥发,生成物浓度减小,导致平衡不断向右移动,故最后不能得到FeCl3固体
Fe(OH)3+3HCl,在加热条件下,由于HCl易挥发,生成物浓度减小,导致平衡不断向右移动,故最后不能得到FeCl3固体
(6)CE
(7)2∶3
(8)在B、C之间和C、D之间分别增加盛有浓硫酸的洗气瓶防止FeCl3潮解
本题解析:(2)为了防止FeCl2溶液水解、氧化应加入稀盐酸、铁粉;(4)做此种类型的题时,首先要明确沉淀以上所含杂质,此题中的杂质是Na+、Cl-,检验沉淀是否洗涤干净,只要检验洗涤后的溶液中是否含有Na+、Cl-中的一种就可以。(5)因为FeCl3易水解,且HCl易挥发,加热促进了FeCl3水解及HCl的挥发,所以不能得到FeCl3固体。(6)悬浮在水中的花粉小颗粒也能做布朗运动。向胶体中加入少量的酸、碱、盐,会中和胶体所带的电荷,使胶体发生聚沉,所以向Fe(OH)3胶体中滴加硫酸,会先出现红褐色Fe(OH)3沉淀,但过量的硫酸还会和Fe(OH)3沉淀发生反应生成硫酸铁。CuSO4属于重金属盐,使蛋白质变性。(7)是有关混合物的计算,设FeCl3为x mol,FeCl2为y mol,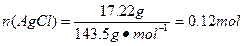
,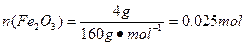 ,依据Cl、Fe守恒3x mol+2y mol="0.12" mol,x mol+y mol="0.025" mol×2,解得x=0.02,y=0.03。(8)因为FeCl3易水解,所以其制备应在无水的条件下进行,即C装置中应干燥,并防止水分进入。
,依据Cl、Fe守恒3x mol+2y mol="0.12" mol,x mol+y mol="0.025" mol×2,解得x=0.02,y=0.03。(8)因为FeCl3易水解,所以其制备应在无水的条件下进行,即C装置中应干燥,并防止水分进入。
本题难度:一般
4、实验题 (16分)某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,因温度不同、受热不均时会生成Fe3O4且也能被磁铁吸引。为探究X的组成,他们进行了如下实验。
Ⅰ.定性检验
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入适量稀盐酸,微热。 | 黑色粉末逐渐溶解,有无色气体逸出。 |
| ② | 向试管1所得溶液中滴加几滴 KSCN溶液,振荡。 | 溶液未出现血红色 |

参考答案:(1)否(2分)?(2)Fe3O4 + 8H+ ="==" Fe2+?+ 2Fe3+ + 4H2O;(2分)
Fe + 2H+ ="==" Fe2+?+ H2↑(2分);? 2Fe3+ + Fe ="==" 3Fe2+?(2分)
(3)过滤,洗涤(2分);?坩埚、泥三角(2分)。
(4)n(Fe3O4)=" 0.0100" mol (2分)? n(Fe)=" 0.0200" mol(2分)
(无保留3位有效数字每空得1分)
本题解析:(1)由于在单质铁的存在下,铁离子是不可能存在的,所以不能确定是否含有四氧化三铁。
(2)有无色气体逸出,说明含有单质铁,反应的方程式是Fe + 2H+ ="=" Fe2+?+ H2↑;又因为还可能存在四氧化三铁,所以还可能发生的反应是Fe3O4 + 8H+ ==Fe2+?+ 2Fe3+ + 4H2O、2Fe3+ + Fe ="==" 3Fe2+。
(3)沉淀从溶液中分离出的方法是过滤,且在过滤之后还必需洗涤;固体的灼烧需要坩埚,而坩埚需要放在三脚架的泥三角上。
(4)设混合物中四氧化三铁和铁的物质的量分别是x和y。由于最终得到的是氧化铁,所以应该有232x+56y=3.44、(3x+y)×160=4.00,解得x=0.0100 mol,y=0.0200 mol,即铁是0.0200 mol,四氧化三铁是0.0100 mol。
本题难度:一般
5、实验题 (4分)右图是铁粉和水蒸气反应的实验装置示意图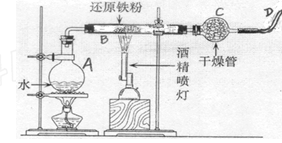
(1)写出该反应的化学方程式?
(2)实验中,D处排出的气体几乎点不着,已知该装置不漏气,使用的各种药品没有质量问题,你认为气体点不着的可能原因是(说出一点即可):?
?
参考答案:(4分)
(1)写出该反应的化学方程式3Fe + 4H2O(g) ?Fe3O4 + 4H2
?Fe3O4 + 4H2
(2)①产生的H2太少,②水蒸气过多
本题解析:
A产生水蒸汽,B、Fe与水蒸汽反应,C、干燥H2,D、导出H2。
⑴化学方程式3Fe + 4H2O(g) ?Fe3O4 + 4H2;⑵H2的含量低,可能量①产生的H2太少,或②水蒸气过多
?Fe3O4 + 4H2;⑵H2的含量低,可能量①产生的H2太少,或②水蒸气过多
本题难度:一般