时间:2017-11-05 22:42:46
1、填空题 Ⅰ、某温度时,在2L密闭容器中将1molNO2分解:2NO2 2NO+O2,达到平衡时,NO的物质的量为0.5mol。平衡时O2的浓度是_______,NO的体积分数是_________。
2NO+O2,达到平衡时,NO的物质的量为0.5mol。平衡时O2的浓度是_______,NO的体积分数是_________。
Ⅱ、一定温度下,往0.1mol/L的ZnSO4溶液与0.1mol/L的CuSO4溶液中通H2S气体至沉淀不再产生则(填化学式)___________溶液的PH比较小。(ZnS?Ksp=1.6×10-24;?CuS?Ksp=1.3×10-36)
Ⅲ、虽然大多数物质的溶解度随温度的升高而增大,但也有一些是随温度的升高而减小的请从下列物质中找出它们_________
A.NaCl?B.Ca(OH)2?C.KNO3?D.CO2?E.油脂
Ⅳ、下列说法正确的是________
A. (NH4)2CO3(s)=NH4HCO3(s)+NH3(g)?属于熵减小的反应
B. 一种物质由液态转变为气态是熵增的过程
C. 吸热反应中,CaCO3(s)==CaO(s)+CO2(g)在高温下不能自发进行
D.?沉淀的转化未必一定是由Ksp大的物质朝Ksp小的物质转化?
参考答案:Ⅰ、0.125mol·L-1;40%
Ⅱ、CuSO4?
Ⅲ、?BD
?Ⅳ、BD
本题解析:
本题难度:一般
2、简答题 取一支洁净试管,向试管中加入0.1mol?L-1AgNO3溶液2mL,再向硝酸银溶液中加入稍过量的铜粉,反应足够长时间后,取上层清液于另一支试管中,再向该试管中滴加0.1mol?L-1KI溶液.回答有关上述实验的下列问题:
(1)可判断硝酸银溶液和铜的反应(正向反应)已确实发生的现象是______.
(2)可判断硝酸银溶液和铜的反应的逆反应也同时发生的现象是______.
(3)实验中若将KI溶液换成KCl溶液,则可能出现什么不同的现象?______.
参考答案:(1)Cu+2AgNO3=Cu(NO3)2+2Ag,AgNO3溶液是无色的,反应发生后,生成物中有铜离子,铜离子在水溶液中的颜色是蓝色的,如果已经反应,无色溶液会变成蓝色,所以可判断硝酸银溶液和铜的反应(正向反应)已确实发生的现象是溶液中出现淡蓝色,故答案为:溶液中出现淡蓝色;
?(2)AgNO3+KI=AgI↓+KNO3 ,AgNO3和KI 反应生成不溶于水的黄色AgI沉淀,如果向上清液中加入碘化钾出现黄色沉淀,就证明上清液中有AgNO3 ,以此可判断硝酸银溶液和铜的反应的逆反应也同时发生,故答案为:上层清液中加入碘化钾出现黄色沉淀;
(3)AgNO3+KCl=AgCl↓+KNO3 ,AgCl是不溶于水的白色沉淀,所以实验中若将KI溶液换成KCl溶液,则可能出现白色沉淀,故答案为:出现白色沉淀.
本题解析:
本题难度:一般
3、选择题 下列说法正确的是( )
A.在一定温度下的AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数
B.AgCl的Ksp=1.8×10-10,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-),且Ag+和Cl-浓度的乘积等于1.8×10-10
C.温度一定时,在AgCl饱和溶液中,Ag+和Cl-浓度的乘积是一个常数
D.向饱和AgCl溶液中加入盐酸,Ksp变大
参考答案:A.如为饱和溶液,则Ag+和Cl-浓度的乘积为Ksp,如溶液未达到饱和,则小于Ksp,故A错误;
B.在含有Ag+或Cl-的溶液中,c(Ag+)、c(Cl-)不一定相等,但Ag+和Cl-浓度的乘积等于1.8×10-10,故B错误;
C.AgCl的Ksp为常数,只受温度的影响,温度一定时,为常数,故C正确;
D.向饱和AgCl溶液中加入盐酸,Ksp不变,只受温度的变化,故D错误.
故选C.
本题解析:
本题难度:简单
4、选择题 某温度下,已知Ksp(AgCl)=1.56×10—10,Ksp(AgBr)=7.7×10—13,Ksp(Ag2CrO4)=9.0×10—12。某溶液中含有Cl—、Br—、CrO42—,浓度均为0.010 mol/L,向该溶液中逐滴加入0.010 mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.Cl—、Br—、CrO42—
B.CrO42—、Br—、Cl—
C.Br—、Cl—、CrO42—
D.Br—、CrO42—、Cl—
参考答案:C
本题解析:当 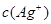 与
与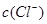 的积超过1.56×10—10有沉淀,当
的积超过1.56×10—10有沉淀,当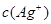 与
与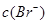 的积超过7.7×10—13,时有沉淀,当
的积超过7.7×10—13,时有沉淀,当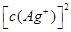 与
与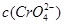 的积超过9.0×10—12时有沉淀,因为Cl—、Br—、CrO42—的浓度相等,所以产生沉淀的顺序为Br—、Cl—、CrO42—,故C正确。sp。
的积超过9.0×10—12时有沉淀,因为Cl—、Br—、CrO42—的浓度相等,所以产生沉淀的顺序为Br—、Cl—、CrO42—,故C正确。sp。
本题难度:简单
5、填空题 在BaCl2溶液中滴加Na2C2O4(草酸钠)溶液,产生白色沉淀,在白色沉淀中加入盐酸,沉淀溶解。
(1)试用离子方程式和有关平衡的知识解释_____________________
(2)根据上述判断,可得出酸盐跟反应的一种规律是_____________________
参考答案:(1)Ba2++C2O42-==BaC2O4↓、BaC2O4+2H+=Ba2++H2C2O4,因BaC2O4沉淀在溶液中存在溶解平衡:
BaC2O4(固)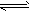 Ba2++C2O42-,使平衡向右移动,促使沉淀溶解
Ba2++C2O42-,使平衡向右移动,促使沉淀溶解
(2)强酸跟弱酸的盐发生复分解反应,生成弱酸
本题解析:
本题难度:一般