时间:2017-11-05 22:42:01
1、填空题 (6分)在①Ar ②干冰③SiO2 ④NH4Cl ⑤K2S⑥金刚石六种物质,按下列要求回答(填序号)
⑴只存在共价键的是?,既存在离子键,又存在共价键的是?;
⑵熔化时不需破坏化学键的是?,熔化时需要破坏共价键的是?;
⑶写出①的电子式是??,④的电子式是??。
参考答案:⑴③⑥;④?⑵?①②?;③⑥;⑶①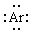 ,④
,④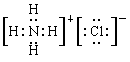 。
。
本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。据此可知①中没有化学键,熔化破坏的是分子间作用力。②中含有极性键,熔化破坏的是分子间作用力。③中含有极性键,熔化破坏的是极 性键。④含有离子键和极性键,熔化破坏的是离子键。⑤含有离子键,熔化破坏的是离子键。⑥含有非极性键,熔化破坏的是非极性键。Ar的电子式为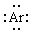 ,氯化铵是离子化合物,电子式为
,氯化铵是离子化合物,电子式为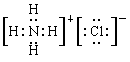 。
。
本题难度:一般
2、选择题 下列叙述正确的是? ( )
A.分子晶体中的每个分子内一定含有极性共价键
B.原子晶体中的相邻原子间只存在非极性共价键
C.含有阴离子的化合物一定含有阳离子
D.金属晶体的熔点和沸点都很高
参考答案:C
本题解析:稀有气体元素最外层电子已经达到稳定结构,其单质分子内不存在化学键。构成原子晶体的元素不一定都是同一种元素,也可以存在极性键。金属晶体的熔沸点有的很低,例如碱金属等。所以正确的答案是C。
本题难度:一般
3、选择题 在碱性溶液中能大量共存且溶液为无色透明的离子组是
A.Ag+、K+、MnO4-、Cl-
B.Ba2+、Na+、Cl-、NO3-
C.K+、Ca2+、NO3-、CO32-
D.Na+、H+、NO3-、SO42-
参考答案:B
本题解析:分析:碱性溶液中存在大量的OH-,离子之间不能结合生成水、气体、沉淀、弱电解质等,则离子能大量共存,并注意离子的颜色来解答.
解答:A.Ag+能分别与Cl-、OH-反应生成沉淀,则不能共存,且MnO4-为紫色,与无色溶液不符,故A错误;
B.碱溶液中该组离子之间不反应,能共存,且离子均为无色,故B正确;
C.因Ca2+、CO32-能结合生成沉淀,则不能共存,故C错误;
D.因H+、OH-反应生成水,则不能共存,故D错误;
故选B.
点评:本题考查离子的共存,明确碱性溶液中离子之间的反应是解答本题的关键,熟悉离子的颜色、物质的溶解性即可解答,题目难度不大.
本题难度:简单
4、选择题
A.0.5 Q
B.Q
C.2 Q
D.5 Q
参考答案:C
本题解析:根据C2H6O+3O2 2CO2+3H2O
2CO2+3H2O
CO2+Ca(OH)2===CaCO3+H2O
则:C2H6O ~ 2CO2~ 2CaCO3~?热量
1 mol? 2 mol? 2×100 g?x
0.5 mol? 1 mol? 100 g?Q
x=Q/0.5=2Q
本题难度:简单
5、选择题 氰化物有剧毒,在碱性条件下可用如下方法进行处理:2CN-+8OH-+5Cl2=2CO2+N2+10Cl-+4H2O,下列判断错误的是
A.上述反应中的氧化剂是Cl2
B.还原性:CN->Cl-
C.当有0.2?mol?CO2生成时,溶液中阴离子的物质的量增加1mol
D.经测定NaCN的水溶液呈碱性,说明CN^促进了水的电离
参考答案:C
本题解析:分析:A.得电子化合价降低的反应物是氧化剂;
B.该反应中,还原剂的还原性大于还原产物的还原性;
C.根据二氧化碳和阴离子的关系式计算;
D.含有弱根离子的盐能促进水电离.
解答:A.该反应中,氯元素的化合价由0价→-1价,所以氯气是氧化剂,故A正确;
B.该反应中的还原剂是CN-,还原产物是Cl-,所以还原性CN->Cl-,故B正确;
C.反应前后,阴离子的个数不变,所以当有0.2?mol?CO2生成时,阴离子的量不变,故C错误;.
D.NaCN的水溶液呈碱性,说明是NaCN是强碱弱酸盐,因其水解而使其溶液呈碱性,含有弱根离子的盐促进水电离,故D正确;
故选C.
点评:本题考查氧化还原反应,注意从化合价的角度分析,正确判断反应中各元素的化合价是做本题的关键.
本题难度:一般