时间:2017-11-05 22:33:23
1、选择题 下列数据不一定随着温度升高而增大的是
[? ]
A.化学反应速率v
B.弱电解质的电离平衡常数Ka
C.化学平衡常数K
D.水的离子积常数Kw
参考答案:C
本题解析:
本题难度:简单
2、选择题 9.已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离的c(H+)的106倍
参考答案:B
本题解析:A项HA电离出的c(H+)为0.1mol/L×0.1%=10-14 mol/L,则pH=-lg(10-4)=4;B项温度升高,促进弱电解质的电离,H+浓度变大,那么pH变小;C项由HA=H++A-知,c(H+)= c(A-)=10-14 mol/L,则电离平衡常数为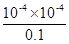 =10-7;D项HA电离出的c(H+)为0.1 mol/L×0.1%=10-14 mol/L,水电离产生的c(H+)=10-10 mol/L,则由HA电离出的c(H+)约为水电离出的c(H+)的106倍。
=10-7;D项HA电离出的c(H+)为0.1 mol/L×0.1%=10-14 mol/L,水电离产生的c(H+)=10-10 mol/L,则由HA电离出的c(H+)约为水电离出的c(H+)的106倍。
考点:弱电解质在水溶液中的电离平衡
点评:本题考查了弱酸的电离,明确离子浓度、温度对电离平衡的影响及离子积的计算时解答本题的关键。
本题难度:一般
3、选择题 下列图示与对应的叙述相符的是: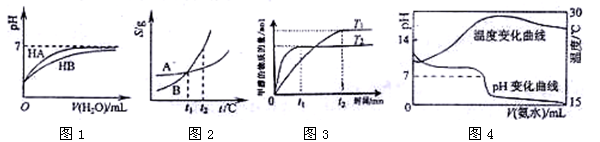
A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH。
B.图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数 B
参考答案:
本题解析:
本题难度:困难
4、选择题 下列有关各溶液的表述正确的是
[? ]
A.0.1 mol·L-1NH4Cl溶液中:c(NH4+)=c(Cl-)
B.将稀硫酸滴入硝酸钠溶液得到的pH=5的混合溶液中:c(Na+)=c(NO3-)
C.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
D.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子有CO32-、HCO3-、OH-
参考答案:BD
本题解析:
本题难度:一般
5、填空题 (1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)______.
A.9?B.13?C.11~13之间?D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)______.
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH-)减小
(3)室温下,如果将0.1mol?NH4Cl和0.05mol?NaOH全部溶于水,形成混合溶液(假设无损失),
①______和______两种粒子的物质的量之和等于0.1mol.
②______和______两种粒子的物质的量之和比OH-多0.05mol.
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)?B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)?D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是______,上述离子浓度大小顺序关系中正确的是(选填序号)______.
②若上述关系中C是正确的,则溶液中溶质的化学式是______.
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)______c(NH3?H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)______c(Cl-).
参考答案:(1)将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的1100,所以溶液的pH应该9-11之间,故选D;
(2)氯化铵溶于水电离出铵根离子,使氨水中的铵根离子浓度增大平衡向左移动,从而抑制氨水电离,故选C;
(3)根据物料守恒知,C(NH4+)+C(NH3.H2O)=0.1mol,根据溶液中电荷守恒得C(Cl-)+c(OH-)=c(H+)+C(NH4+)+C(Na+),c(H+)+C(NH4+)-c(OH-)=C(Cl-)-C(Na+)=0.1mol-0.05mol=0.05mol,
故答案为:①NH4+、NH3.H2O;②NH4+、H+;
(4)①因任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,铵根离子水解方程式为NH4++H2O?NH3.H2O+H+,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即A符合,故答案为:NH4Cl;A;
②C中离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl,
故答案为:NH4Cl和HCl;
③氯化铵是强酸弱碱盐其水溶液呈酸性,要使氯化铵溶液呈中性,则氨水应稍微过量,因为盐酸和氨水的体积相等,则盐酸的物质的量浓度小于氨水,溶液呈中性,溶液中氢离子浓度等于氢氧根离子浓度,溶液呈电中性,所以溶液中氯离子浓度等于铵根离子浓度,故答案为:<,=.
本题解析:
本题难度:一般