时间:2017-11-05 22:29:20
1、选择题 燃烧下列混合气体,所产生的CO2的量一定小于燃烧同质量的丙烯所产生CO2量的是
A.乙烯、丙烷
B.乙烷、环丙烷(C3H6)
C.乙炔、丙烷
D.乙烯、丙烯
参考答案:AB
本题解析:等质量有机物完全燃烧时生成CO2的量决定于有机物的含碳量。在给定的6种有机物中,其含碳量为乙炔>乙烯=丙烯=环丙烷>丙烷>乙烷,则含碳量一定比丙烯低的组合是A项和B项。
本题难度:一般
2、选择题 下列离子方程式与所述事实相符且正确的是
A.H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑
B.用双氧水和稀硫酸处理铜板:Cu+H2O2+2H+=Cu2++2H2O
C.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
D.铵明矾[AlNH4(SO4)2?12H2O]溶液中加入过量氢氧化钡溶液:Al3++NH4++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3?H2O+2H2O
参考答案:BD
本题解析:分析:A.发生氧化还原反应生成NaOH和氧气,水既不是氧化剂也不是还原剂;
B.发生氧化还原反应生成硫酸铜和水;
C.反应生成碳酸钙和HClO;
D.[AlNH4(SO4)2?12H2O]完全反应.
解答:A.H218O中投入Na2O2固体的离子反应为2H218O+2Na2O2=418OH-+O2↑4Na+,故A错误;
B.用双氧水和稀硫酸处理铜板的离子反应为Cu+H2O2+2H+=Cu2++2H2O,故B正确;
C.漂白粉溶液在空气中失效的离子反应为Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓,故C错误;
D.铵明矾[AlNH4(SO4)2?12H2O]溶液中加入过量氢氧化钡溶液的离子反应为Al3++NH4++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3?H2O+2H2O,故D正确;
故选BD.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意反应的实质,选项A中的氧化还原及D中与量有关的离子反应为解答的难点,题目难度中等.
本题难度:一般
3、选择题 下列各组物质中互为同分异构体的是
A.金刚石和石墨
B.蔗糖和麦芽糖
C.O2和O3
D.淀粉和纤维素
参考答案:B
本题解析:
本题难度:困难
4、选择题 10 mL某种气态烃,在50 mL氧气里充分燃烧,得到液态水和体积为35 mL的混合气体(所有气体体积都是在同温同压下测定的),则该气态烃可能是
A.甲烷
B.乙烷
C.丙烷
D.丁烯
参考答案:B
本题解析:根据题意,氧气充足,CxHy+(x+y/4)→xCO2+y/2H2O,体积减少25 mL,减少体积与烃的体积成正比关系,1∶(1+x+y/4-x)=10∶25,得y=6.
本题难度:简单
5、选择题 将11.2g的Mg-Cu混合物完全溶解于足量的硝酸中,收集反应产生的X气体(假定产生的气体全部逸出).再向所得溶液中加入足量的NaOH溶液,产生21.4g沉淀.气体X的成分可能是
A.0.3mo1NO2和0.3mo1NO
B.0.1mol NO、0.2mol NO2和0.05mol N2O4
C.0.2mo1NO2和0.1mo1N2O4
D.0.6mo1NO
参考答案:B
本题解析:分析:向Mg-Cu混合物与足量的硝酸反应所得溶液中加入足量的NaOH溶液,产生21.4g沉淀为氢氧化镁、氢氧化铜,所以沉淀中氢氧根的质量为21.4g-11.2g=10.2g,物质的量为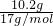 =0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,结合选项根据电子转移守恒判断.
=0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,结合选项根据电子转移守恒判断.
解答:向Mg-Cu混合物与足量的硝酸反应所得溶液中加入足量的NaOH溶液,产生21.4g沉淀为氢氧化镁、氢氧化铜,所以沉淀中氢氧根的质量为21.4g-11.2g=10.2g,物质的量为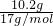 =0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,
=0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,
A、生成0.3mo1NO2和0.3mo1NO,N元素获得电子为0.3mol×(5-4)+0.3mol×(5-2)=1.2mol,得失电子不相等,故A错误;
B、生成0.1mol NO、0.2mol NO2和0.05mol N2O4,N元素获得电子为0.1mol×(5-2)+0.2mol×(5-4)+0.05mol×2×(5-4)=0.6mol,得失电子相等,故B正确;
C、生成0.2mo1NO2和0.1mo1N2O4,N元素获得电子为0.2mol×(5-4)+0.1mol×2×(5-4)=0.4mol,得失电子不相等,故C错误;
D、生成0.6molNO,N元素获得电子为0.6mol×(5-2)=1.8mol,故D错误.
故选:B.
点评:考查混合物的计算、氧化还原反应计算等,难度中等,计算金属提供的电子的物质的量是解题的关键,注意守恒思想的运用.
本题难度:简单