时间:2017-11-05 22:28:56
1、推断题 现有原子序数小于20的A、B、c、D、E、F 6种元素,它们的原子序数依次增大,已知B元素是地壳中含量最多的元素;A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的1/2;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的P轨道上比D原子的p轨道上多一个 电子;6种元素的基态原子中,F原子的电子层数最多且和A处于同一主族。回答答下列问题:
(1)用电子式表示C和E形成化合物的过程________________________
(2)写出基态F原子的核外电子排布式_____________。
(3)写出A2D的电子式____________,其分子中_______(填“含” 或“不含”)σ键,______(填“含”或“不含”)π键。
(4)A、B、C共同形成的化合物中化学键的类型有_______________
参考答案:(1)
(2)1s22s22p63s23p64s1
(3) ;含;不含
;含;不含
(4)离子键、共价键
本题解析:
本题难度:一般
2、选择题 下列各组中的三种酸,按酸性由强到弱的顺序排列的是
[? ]
参考答案:C
本题解析:
本题难度:一般
3、选择题 用下图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中现象与结论均正确的是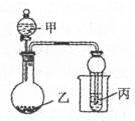
| 选项 | 甲 | 乙 | 丙 | 试管中现象 |
| A | 浓盐酸 | 二氧化锰 | 石蕊溶液 | 先变红后褪色 |
| B | 浓氨水 | 生石灰 | A1Cl3溶液 | 先沉淀后消失 |
| C | 醋酸 | 碳酸钙 | BaC12溶液 | 变浑浊 |
| D | 浓硝酸 | 铜 | 水 | 试管口出现红棕色 |
参考答案:D
本题解析:A.浓盐酸与MnO2在加热时发生反应产生Cl2.该装置为加热,反应不能发生。错误。B.把浓氨水滴加在生石灰上,由于CaO与水发生反应,消耗水,产生的Ca(OH)2溶解放热,会加速氨水的分解,产生氨气。把氨气通入到A1Cl3溶液中,发生反应:?Al3++3NH3+3H2O=3 NH4++Al(OH)3↓.因为NH3·H2O是弱碱,不能溶解产生的Al(OH)3沉淀。因此现象有误。错误。C.把醋酸加入到碳酸钙中,发生反应:2CH3COOH+CaCO3=(CH3COO)2Ca+ H2O+ CO2↑.把气体通入到BaC12溶液中时,因为酸性HCl>H2CO3。所以不会发生反应,试管中不会出现浑浊现象。错误。D.浓硝酸在常温下与Cu发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 。3NO2+H2O = 2HNO3+NO。O2+2NO=2NO2。NO2是红棕色的气体。正确。
本题难度:一般
4、选择题 已知铍(Be)的原子序数为4,下列对铍及其化合物的叙述中,正确的是
A.铍的原子半径小于硼的原子半径
B.铍与等浓度盐酸的反应比镁剧烈
C.氢氧化铍的碱性比氢氧化钙弱
D.单质铍能与冷水反应产生氢气
参考答案:C
本题解析:同一周期,从左到右,原子半径逐渐减小,所以铍的原子半径大于硼的原子半径;同一主族,从上到下,金属性逐渐增强,即金属性铍<镁<钙,以镁的性质推断铍、钙的性质,则B、D项均不正确,C项正确.
本题难度:困难
5、填空题 按要求填空:
(1)碱金属元素原子半径最小的是______,它作为新一代绿色可充电池的材料,放电时它是电池的______?极(填“正”或“负”);卤族元素中原子最外层的电子数都是______个,在化学反应中它们容易得到______个电子.在卤族元素中非金属性最强的元素是______,其离子的结构示意图:______;
(2)为防止碳素钢菜刀生锈,使用后特别是切过咸菜后,应采取的简易措施是______;?生活中和生产上最常用的燃料里所含的主要元素有______,它们在燃烧后生成的化合物主要是______.
(3)相对分子质量为58的烷烃的分子式是______,它可能的结构简式是______、______
(4)已知某反应的各物质浓度数据如下:aA(g)+bB(g)
2C(g)
起始浓度(mol/L):1.5?1.0?0
2s末浓度(mol/L):0.9?0.8?0.4
则①a=______,b______.
②2S内B的反应速率=______.
③3s末上述反应达平衡时,C浓度为0.6mol/L,则A的转化率为______.
(5)(6分)丙烯通入溴水中褪色的化学方程式:______(反应类型:______)硝基苯生成的化学方程式:______(反应类型:______)
参考答案:(1)碱金属元素的原子,从上到下原子半径逐渐增大,原子半径最小的是金属锂,锂电池放电时,锂是电池的负极,卤族元素的原子,从上到下非金属性逐渐减弱,所以非金属性最强的元素是F,第ⅤⅡA元素称为卤族元素,最外层电子数是7在化学反应中它们容易得到1个电子,形成8电子稳定结构,故答案为:锂;负;7;1;氟;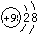
;
(2)铁生锈的原理是金属铁和水及空气接触,切过咸菜后的菜刀,防止生锈的简单做法是:立即将菜刀擦拭干净,生活中最常用的燃料是天然气,燃烧产物是水和二氧化碳,故答案为:立即将菜刀擦拭干净;C、H;CO2和H2O;
(3)烷烃具有通式:CnH2n+2,相对分子质量为14n+2,当相对分子质量为58时,所以n=4,即为丁烷,具有2种同分异构体:正丁烷和异丁烷,故答案为:C4H10;CH3-CH2-CH2-CH3;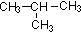
;
(4)①A和B的浓度的变化量分别为:0.6mol/L和0.2mol/L,浓度的变化量之比等于方程式的系数之比,所以a=3,b=1,故答案为:3;1;
②2S内B的反应速率v=△ct=1.0mol/L-0.8mol/L2s=0.1mol/(L?S),故答案为:0.1mol/(L?S);
③3s末上述反应达平衡时,C浓度为0.6mol/L,则消耗的A的浓度为0.9mol/L,A的转化率=A的浓度或物质的量的变化量初始浓度或变化量×100%=0.9mol/L1.5mol/L×100%=60%,故答案为:60%;
(5)溴水和丙烯之间发生加成反应,原理是: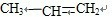
+Br2→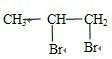
,属于加成反应,苯和浓硫酸以及浓硝酸的混合酸反应生成硝基苯,即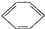
+HO-NO2浓硫酸
本题解析:
本题难度:一般