时间:2017-11-05 22:22:26
1、选择题 向一定量的Fe、FeO和Fe2O3的混合物中加入140 mL5mol/L的稀硝酸,恰好使混合物完全溶解,放出2.24 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为? ( )
A.0.24 mol
B.0.21 mol
C.0.25 mol
D.0.14 mol
参考答案:C
本题解析:
无正确答案
n(Fe2+)=[n(HNO3)―n(NO)]÷2="[0.140" L×5mol/L―2.24 L÷22.4L/mol]÷2=0.25mol
本题难度:一般
2、填空题
(1)写出Cu制取CuSO4(稀H2SO4环境下)的方程式________________;
(2)Cu与浓H2SO4共热也能制取CuSO4,其反应方程式为:________________;以上两种制取方法________________者好(填“前”或“后”),原因是________________。
参考答案:(1)2H2SO4+O2+2Cu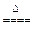 2CuSO4+2H2O
2CuSO4+2H2O
(2)2H2SO4(浓)+Cu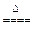 CuSO4+SO2↑+2H2O?前?节省硫酸用量,无污染物排放
CuSO4+SO2↑+2H2O?前?节省硫酸用量,无污染物排放
本题解析:在加热条件下,Cu与O2作用转变为CuO,CuO可溶于稀H2SO4生成CuSO4和H2O。
本题难度:简单
3、简答题 在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应.请设计实验,证明还原铁粉与水蒸气能够发生反应.
(1)铁粉与水蒸气反应的化学方程式是:______
(2)证明还原铁粉与水蒸气发生了反应的方法是______
(3)某同学用如图所示装置进行实验,请帮助该同学完成设计,用下列简图画出未完成的实验装置示意图(铁架台可省略,导气管的形状可根据需要选择)
(4)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤.若混合物中既有Fe2+又有Fe3+,则证明该结论的实验方法是:______
(5)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含+3价的Fe元素.原因是(结合离子方程式说明)
______
(6)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色.
①沉淀由白色→红褐色的化学方程式是:______.
②为了得到白色的Fe(OH)2沉淀,并尽可能长时间保持其白色,可采取的措施有多种,请写出其中的一种.______.
参考答案:(1)铁和水蒸气反应的化学方程式为:3Fe+4H2O(g)??△?.??Fe3O4+4H2↑,故答案为:3Fe+4H2O(g)??△?.??Fe3O4+4H2↑;
(2)证明还原铁粉与水蒸气发生了反应的方法是收集气体进行爆鸣实验,证明铁发生了反应,故答案为:检验是否有H2产生;
(3)氢气的密度比空气的小,且不溶于水,实验装置示意图
,故答案为:
;
(4)Fe3+使KSCN溶液变红,Fe2+使高锰酸钾酸性溶液褪色,故答案为:各取少量溶液于两试管中,向其中一试管中滴入几滴KSCN溶液,向另一试管中加入高锰酸钾酸性溶液,观察溶液颜色变化,若前者溶液颜色变红,后是溶液紫红色褪去,则说明溶液中既有Fe2+又有Fe3+;
(5)铁粉将溶液中的Fe3+全部还原为Fe2+,即便加KSCN溶液也不变红色,故答案为:如果反应后混合物中的铁粉过量,铁粉将溶液中的Fe3+全部还原为Fe2+,即便加KSCN溶液也不变红色.反应的离子方程式为Fe+2Fe3+=3Fe2+;
(6)①氧气能将Fe(OH)2沉淀氧化为氢氧化铁,化学方程式:4Fe(OH)2+O2+2H2O═4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
②Fe(OH)2沉淀易被氧气氧化,应除掉溶液中的氧气和隔绝空气,故答案为:第一种:用一只容器较大针孔较细的注射器吸取滤液后再吸入NaOH溶液,然后倒置2~3次;
第二种:向滤液中加入植物油,使滤液与空气隔绝,然后再将滴管伸入水溶液中滴加氢氧化钠溶液;
第三种:向热的硫酸亚铁溶液中滴加热的氢氧化钠溶液,减少溶液中氧气的含量.
本题解析:
本题难度:一般
4、选择题 下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A.D为金属单质,其他均为化合物.试回答下列问题: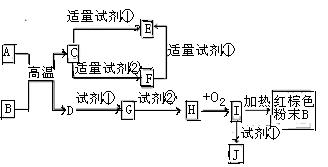
(1)写出物质C的化学式:?
(2)写出物质B的一种用途:?
(3)以J的饱和溶液制备胶体的操作为?
? ?。
?。
(4)写出下列反应的方程式:
A→F的离子方程式?.
H→I的化学方程式??
试剂②可以由一种淡黄色固体粉末和一种常见液体发生反应而制得,其相应的化学方程式?
(5)某同学认为J中可能同时含有同一种金属元素的两种阳离子,若要确认其中低价金属阳离子的存在,应选用?(选填序号)
A、KSCN溶液和氯水? B、铁粉和KSCN溶液? C、浓氨水? D、酸性高锰酸钾?
参考答案:(1) Al2O3 (2分)
(2)常用作红色油漆和涂料(写出其中一种即得分)(2分)?
(3)取一个烧杯,加入20mL蒸馏水,加热至沸,然后向沸水中滴加I的饱和溶液(或者氯化铁饱和溶液)1mL~2mL,继续煮沸,待溶液(或者液体)呈红褐色为止;(3分,关键词,每处1分)
(4) 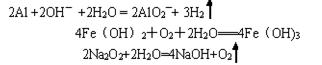
(5)D
本题解析:略
本题难度:一般
5、计算题 将6g纯铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中充分反应后得到200mL0.5mol/L的FeSO4溶液和5.2g固体,求: (1)反应后生成铜多少克?
(1)反应后生成铜多少克? (2)加入铁粉前Fe2(SO4)3物质的量浓度。
(2)加入铁粉前Fe2(SO4)3物质的量浓度。
参考答案:(1)2.56g(2)0.1mol/L
本题解析: 发生反应的化学方程式为:
发生反应的化学方程式为: ①Fe+Fe2(SO4)3=3FeSO4?②Fe+CuSO4=Cu+FeSO4
①Fe+Fe2(SO4)3=3FeSO4?②Fe+CuSO4=Cu+FeSO4 两个反应共生成FeSO4为:0.2L×0.5mol/L=0.1mol
两个反应共生成FeSO4为:0.2L×0.5mol/L=0.1mol 观察两个反应不难发现,若生成同样的FeSO4,②式消耗的铁更多。假设0.1molFeSO4全部为②式产生,则此时消耗的铁将达最大量为a。
观察两个反应不难发现,若生成同样的FeSO4,②式消耗的铁更多。假设0.1molFeSO4全部为②式产生,则此时消耗的铁将达最大量为a。



 ?
? ?Fe?~? FeSO4
?Fe?~? FeSO4 ? 1mol? 1mol
? 1mol? 1mol ? a? 0.1mol
? a? 0.1mol a=0.1mol,即铁为5.6g,则5.2g固体中含Cu也含剩余的Fe,设原溶液的Fe2(SO4)3和CuSO4的物质的量分别为x和y。
a=0.1mol,即铁为5.6g,则5.2g固体中含Cu也含剩余的Fe,设原溶液的Fe2(SO4)3和CuSO4的物质的量分别为x和y。 Fe+Fe2(SO4)3=3FeSO4? Fe+CuSO4=Cu+FeSO4
Fe+Fe2(SO4)3=3FeSO4? Fe+CuSO4=Cu+FeSO4 X? x? 3x? y? y? y? y
X? x? 3x? y? y? y? y
 由题意得? 3x+y=0.1mol
由题意得? 3x+y=0.1mol ? 6g-56g/mol×(x+y)+64g/mol×y=5.2g
? 6g-56g/mol×(x+y)+64g/mol×y=5.2g 解得:x="0.02mol?" y=0.04mol
解得:x="0.02mol?" y=0.04mol 则生成铜:0.04mol×64g/mol=2.56g
则生成铜:0.04mol×64g/mol=2.56g 原Fe2(SO4)3和物质的量浓度为0.02mol/0.2L=0.1mol/L
原Fe2(SO4)3和物质的量浓度为0.02mol/0.2L=0.1mol/L
本题难度:一般