时间:2017-11-05 22:21:14
1、选择题 下列物质中,只含有共价键的是
A.Na2O
B.NaCl
C.HCl
D.NaOH
参考答案:C
本题解析:A错,Na2O只含有离子键;B错,.NaCl只含离子键;C正确;D错,NaOH即有离子键又有极性键;
本题难度:简单
2、选择题 下列含有非极性键的共价化合物是
[? ]
参考答案:C
本题解析:
本题难度:简单
3、填空题 现有1——20号元素A、B、C、D所对应的物质的性质或微粒结构如下表:
| 元素 | 物质性质或微粒结构 |
| A | M层上有2对成对电子 |
| B | B的离子与D的离子具有相同电子层结构,且可以相互组合形成干燥剂 |
| C | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| D | 元素最高正价是+7价 |
参考答案:(本题共8分,每空1分)
(1)6,2,CaCl2?
(2)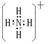
(3)Cl,C
(4)分子,2NH3+H2SO4→(NH4)2SO4
本题解析:M层上有2对成对电子可推出A原子3P轨道分布了4个电子,为S;根据C的氢化物水溶液呈碱性可知C为N;1—20号元素元素最高正价是+7价只有Cl,所以D为Cl元素;B的离子与D的离子具有相同电子层结构,且可以相互组合形成干燥剂,可推出D为Ca元素。
(1)S原子最外层为6个电子,既有6种电子运动状态,分布在3S、3P轨道上,有2种能量不同的电子,Cl?与Ca2+形成的干燥剂为CaCl2。
(2)N元素与氢元素形成带一个单位正电荷的离子为NH4+。
(3)根据元素周期律和元素周期表,Cl的非金属性大于S;一定条件下Cl2能从H2S水溶液中置换出S单质,说明Cl原子的得电子能力大于S原子,Cl元素的非金属性大于S元素。
(4)C的氢化物为NH3,固态时属于分子晶体,A的最高价氧化物水化物为H2SO4,二者反应生成(NH4)2SO4。
本题难度:一般
4、填空题 已知H2O2分子的结构如图所示,H2O2分子不是直线形的,两个氢原子犹如在半展开的书的两面上,氧原子则在书的夹缝上,书面夹角为94°,而O-H键与O-O键的夹角均为97°。试回答 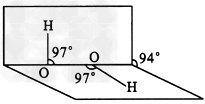
(1)写出H2O2分子的电子式和结构式______________________;
(2)写出分子内的键型________________;
(3)估计它难溶于CS2,简要说明原因______________________;
(4)指出氧元素的化合价,简要说明原因____________________。
参考答案:(1)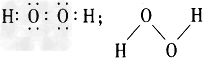
(2)分子内既有极性键又有非极性键
(3)因过氧化氢为极性分子,而二硫化碳为非极性溶剂,根据相似相溶原理,过氧化氢难溶于二硫化碳中
(4)O为-1价,因O-O键为非极性键,而O-H键为极性键,共用电子对偏向于氧,故为-1价。
本题解析:
本题难度:一般
5、选择题 用下图表示的一些物质或概念间的从属关系中正确的是
| ? | X | Y | Z |
| A | 混合物 | 胶体 | 分散系 |
| B | 纯净物 | 碱 | 纯碱 |
| C | 化合物 | 电解质 | BaSO4 |
| D | 化学反应 | 非氧化还原反应 | 复分解反应 |

参考答案:CD
本题解析:略
本题难度:简单