时间:2017-11-05 22:20:49
1、填空题 钛(Ti?)被称为继铁、铝之后的第三金属.如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.请填写下列空白: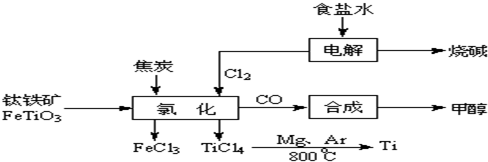
(l)电解饱和食盐水时,总反应的离子方程式是______.
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式(不用写条件)______.
(3)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ?mol-1
②Ti(s)+2Cl2(g)=TiCl4(s)△H=-770kJ?mol-1
则2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s)△H=______.
反应2Mg(s)+TiCl4(s)
2MgCl2(s)+Ti,在Ar气氛中进行的理由是:______.
(4)在上述产业链中,合成96t?甲醇理论上需额外补充H2______?t?(不考虑生产过程中物质的任何损失).
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.已知该燃料电池的总反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,正极发生的电极方程式为:3O2+6H2O+12e-=12OH-.该电池中负极上的电极反应式是______.
参考答案:(1)因电解饱和食盐水时,Cl-在阳极放电,H+在阴极放电,所以反应的离子方程式是:2Cl-+2H2O?
2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O?
2OH-+H2↑+Cl2↑ ?
(2)按流程图找出反应物和生成物,方程式为:2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO
(3)反应2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s)可看做反应①×2-②得到,根据盖斯定律得△H-641kJ/mol×2-(-770 kJ/mol)=-512kJ?mol-1
?反应2Mg(s)+TiCl4(s)
2MgCl2(s)+Ti(s)在Ar气氛中进行的理由是Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化.
故答案为:-512?kJ/mol;Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化.
? (4)CO+2H2→CH3OH?
? ?28? 4 ?32
? X ?Y?96吨
解得:X=84吨? Y=12吨?
? 2FeTiO3+6C+7Cl2=2FeCl3+2TiCl4+6CO
?497?168?
?Z?84吨
解得:Z=248.5吨
? 2Cl-+2H2O?
2OH-+H2↑+Cl2↑
? 2? 71
?P?248.5吨
解得:P=7吨
所以需额外补充H25t,
故答案为:5
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,正极反应为:3O2+12H2O+12e-=12OH-,总反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,两式相减,负极反应为:2CH3OH-12e-+16OH-=2CO32-+12H2O,
故答案为:2CH3OH-12e-+16OH-=2CO32-+12H2O.
本题解析:
本题难度:一般
2、选择题 在自然界中以游离态存在的金属是( )
A.铁
B.金
C.钠
D.铝
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列叙述正确的是( )
A.活泼金属钠用电解法冶炼
B.铜可以用置换法和电解法冶炼得到
C.汞的冶炼只能用还原剂法
D.铝的冶炼一般用还原剂法
参考答案:A
本题解析:
本题难度:简单
4、选择题 中学阶段介绍的应用电解法制备的物质主要有三种:一是铝的工业制备;二是电解饱和NaCl溶液制备烧碱; 三是金属钠的制备。下列关于这三个工业生产的描述中正确的是
[? ]
A.电解法制铝时一般是用熔融态的氧化铝进行电解,但也可用其相应的盐如熔融态的AlCl3
B.电解法生产铝时,每转移3mol电子的时候,就能生产出1mol的铝
C.在电解饱和NaCl溶液中,电解池中的阴极产生的是H2,NaOH在阳极附近产生
D.电解饱和NaCl溶液和金属钠的冶炼都用到了NaCl,电解时阴极都是Cl-失电子
参考答案:B
本题解析:
本题难度:一般
5、填空题 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题
(1)若两池中均为CuSO4溶液,反应一段时间后:
有红色物质析出的是甲池中的_____棒,乙池中的____棒。乙池中阳极的电极反应式是_____________。
(2)若两池中均为饱和NaCl溶液:
写出乙池中总反应的离子方程式____________________。
甲池中碳极上电极反应式是____________________,乙池碳极上电极反应属于______(填“氧化反应”或“还原反应”)。
将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的化学方程式为___________________。
若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混合均匀后的PH=______。
参考答案:(1)碳;铁;4OH--4e-==2H2O+O2↑
(2)2Cl-+2H2O Cl2↑+H2↑+2OH-;2H2O+O2+4e-==4OH-;氧化反应;Cl2+2KI==I2+2KCl;13
Cl2↑+H2↑+2OH-;2H2O+O2+4e-==4OH-;氧化反应;Cl2+2KI==I2+2KCl;13
本题解析:
本题难度:一般