时间:2017-11-05 20:49:46
1、填空题 (14分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图: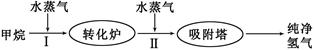
(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1[来源:] |
| B | 0、0、2、2 | c2 | Q2 | α2 ? |
| C | 2、2、0、0 | c3 | Q3 | α3 |
参考答案:(1)放;66.7%(2)AD (3)②③(4)降低温度,或增加水蒸汽的量,或减少氢气的量;(每格2分)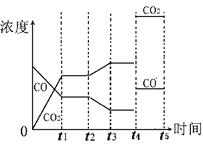
本题解析:(1)温度越高,平衡常数越小,所以正反应是放热反应。
CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g)
起始量(mol)? 1? 2? 0? 0
转化量(mol)? x? x? x? x
平衡量(mol)? 1-x? 2-x? x? x
根据平衡常数知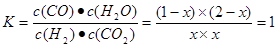
解得x=2/3,所以平衡后CO的转化率为是66.7%。
(2)因为反应前后体积,即改变压强平衡不会发生移动,根据所给的反应物投入量来看ABC就是等效的,虽然氢气的含量,但氢气的浓度不同,其中BC相等且都是A的2倍。根据500℃平衡常数可计算出A中反应物的转化率均是75%【计算方法同(1)】,即平衡时A中CO、H2O、H2、CO2分别是0.25mol、0.25mlol、0.75mol、0.75mol,则平衡时B、C中CO、H2O、H2、CO2分别都为0.5mol、0.5mol、1.5mol、1.5mol。即B、C中转化率分别是25%和75%。A中放热Q1,所以反应热是-2Q1kJ·mol-1。则C中放热2Q1,B中吸热Q1。答案AD正确。
(3)因为体系绝热,而反应是放热反应,所以压强会发生变化,①⑤可以。反应前后气体质量和容器的体积均不发生变化,所以密度不变,②不可以。反应前后气体质量和物质的量均不发生变化,所以相对分子质量不变,③不可以。④⑥符合化学平衡的概念正确。答案是②③。
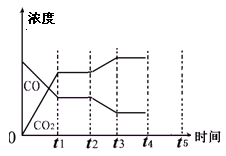
(4)由图像可知t2时刻CO浓度减小,CO2浓度增大,因此改变的条件是降低温度,或增加水蒸汽的量。t4时刻通过改变容积的方法将压强增大为原先的两倍,平衡不移动,但物质的浓度均增大,都变为原来大2倍,如图所示: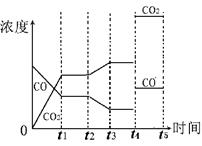
本题难度:一般
2、选择题 某原电池装置如下图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂。下列叙述正确的是
A.原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大
B.此电池工作原理与硅太阳能电池工作原理相同
C.Fe为正极,石墨上发生的反应为:2H++2e-=H2↑
D.若装置中的盐桥用铁丝代替,电流表指针有偏转
参考答案:A
本题解析:A、Fe为负极,阴离子向负极移动,则FeCl2溶液中c(Cl-)会增大,故A正确;B、此电池工作原理与硅太阳能电池工作原理不相同,硅太阳能电池是光电转换,B错误;C、铁负极,石墨为正极,C错误;D、电子不能通过溶液,则原电池装置中的盐桥完不能用金属导线代替,因此若装置中的盐桥用铁丝代替,电流表指针无偏转,D错误,答案选A。
考点:考查原电池原理的应用
本题难度:一般
3、填空题 从能量转化的角度看,原电池是一种由______能转变成______能的装置;用锌片、铜片和稀盐酸组成的原电池,负极是______,正极的电极反应是______,正极发生______反应(填“氧化”或“还原”)
参考答案:原电池是将化学能直接转换为电能的装置,锌片、铜片和稀盐酸组成的原电池,较活泼的金属锌做负极,金属铜作正极,正极是稀盐酸中的氢离子得到电子化合价降低的还原反应,电极反应为:2H++2e-=H2↑,故答案为:化学;电;Zn;2H++2e-=H2↑;还原.
本题解析:
本题难度:一般
4、选择题 网易探索2010年5月20日报道,来自法国格勒诺布尔(Grenoble)约瑟夫·傅立叶大学的研究小组发明了第一块可为人体人造器官提供电能的可植入的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶的作用下发生的总反应为C6H12O6+6O2=6CO2+6H2O(酸性环境),下列对该电池说法不正确的是?
[? ]
A.?电池消耗1mol氧气则转移4mole-,可产生22.4LCO2气体
B.?放电过程中,H+会向正极移动
C.?电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+
D.?今后研究的研究方向是怎样提高葡萄糖生物燃料电池的效率,从而在将来达到可以利用葡萄糖生物燃料电池为任何可植入医疗设备提供电能
参考答案:A
本题解析:
本题难度:一般
5、填空题 (1)下列能构成原电池的是______(A、B、C、D中的电解质溶液均为稀硫酸)(填编号)
(2)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
①B中Cu极电极反应式为______;
②C中被溶解的金属是______,总化学反应方程式为______;
③A.B、C中铁被溶解的速率,由大到小的顺序是______.
参考答案:(1)A、B、C符合原电池的构成条件,D没有构成闭合回路,所以不能构成原电池.
故选ABC;
(2)①该电池中,铁失电子生成二价铁离子进入溶液,铁片逐渐溶解,所以铁作负极,铜作正极,正极上氢离子得电子生成氢气,所以电极反应式为2H++2e-=H2↑.
故答案为:2H++2e-=H2↑;
②该电池中锌失电子生成锌离子进入溶液,所以锌逐渐溶解,锌作负极,铁作正极,
电池反应式为:Zn+H2SO4=ZnSO4+H2↑,故答案为:Zn;Zn+H2SO4=ZnSO4+H2↑;
③通过以上分析知,B装置加快了铁片的溶解,C装置减慢了铁片的溶解,所以反应速率由大到小的顺序是B>A>C.
故答案为:B>A>C.
本题解析:
本题难度:一般