时间:2017-11-05 20:34:47
1、选择题 把a、b、c、d四块金属片浸人稀酸中,用导线两两相连组成原电池。若a、b相连时,a为负极,c、d相连时,电流由d到c;a、c相连时c极上产生大量气泡,b、d相连时, b上有大量气泡产生,则四种金属的活动性顺序由强到弱的顺序为
[? ]
A.a>b>c>d
B.a>c>d>b
C.c>a>b>d
D.b>d>c>a
参考答案:B
本题解析:
本题难度:一般
2、选择题 将图所示实验装置的K闭合,下列判断正确的是( )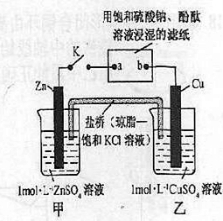
A.Cu电极上发生氧化反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(SO42-)增大
D.片刻后可观察到滤纸a点变红色
参考答案:A.K闭合时,甲乙装置能自发的进行氧化还原反应,所以甲乙构成原电池,锌易失电子而作负极,铜作正极,铜电极上得电子发生还原反应,故A错误;
B.电子不进入电解质溶液中,故B错误;
C.片刻后,甲池中锌失电子生成锌离子进入溶液,硫酸根离子浓度不变,故C错误;
D.电解池阴极a上氢离子放电,同时生成氢氧化钠,酚酞遇碱变红色,所以滤纸a点变红色,故D正确;
故选D.
本题解析:
本题难度:一般
3、选择题 某小组为了研究电化学原理设计了如图所示的装置,下列说法中错误的是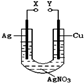
A.X和Y不连接时,铜棒上会有金属银析出
B.X和Y用导线连接时,银棒是正极,发生氧化反应
C.若X接直流电源的正极,Y接负极,Ag+向铜电极移动
D.无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色
参考答案:B
本题解析:A.X和Y不连接时,铜可以置换出银单质,正确;B.X和Y用导线连接时,构成原电池,Ag做正极,发生还原反应,Cu作负极,发生氧化反应,错误;C.若X接直流电源的正极,Y接负极,构成电解池,Ag做阳极,Cu作阴极,Ag+向铜电极移动,正确;D.无论X和Y是否连接,铜都会失去电子变成铜离子,正确。
考点:考查电化学原理。
本题难度:一般
4、选择题 下列说法不正确的是
A.铅蓄电池在放电过程中,正负极质量均增加
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H> O
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小
D.将浓度为0.1mol·L-1的HF溶液加水不断稀释,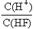 的值始终保持增大
的值始终保持增大
参考答案:C
本题解析:铅蓄电池在放电过程中,正极反应式是Pb-2e-+SO42-=PbSO4↓,负极反应式PbO2+2e-+4H++ SO42-=+2H2O+ PbSO4,A正确;反应C(s)+CO2(g)=2CO(g)需在高温下才能进行,根据吉布斯自由能G =" H" – TS,可知B正确;Ksp只与温度有关,C错误;HF溶液加水不断稀释,电离平衡常数K=,因为K不变,[F-]不断减小,故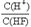 的值始终保持增大,D正确。
的值始终保持增大,D正确。
点评:《化学反应原理》一书是高考的重难点,考生在备考过程中应注意抓住各章节的重点,通过常见的考题,学会灵活分析应用。
本题难度:一般
5、填空题 (8分)现有如下两个反应:
(A)NaOH + HCl="===" NaCl + H2O?(B)Zn + CuSO4 = ZnSO4 + Cu
(1)根据两反应本质, 判断能设计成原电池的是?。
(2)根据你的选择完成下列问题:
正极材料:?;负极材料:?
电解质:?。
正极反应式为:?
负极反应式为:?
参考答案:(1)? B? 1 分?(2) Cu? 1分? Zn? 1分? CuSO4?1分
Cu2+?+2e- ="==" Cu? Zn-2e-===Zn2+?各2分
本题解析:(1)在原电池中,有电子的移动,说明只有氧化还原反应才能设计成原电池。A是中和反应,不是氧化还原反应,不能设计成原电池。B是氧化还原反应,可以设计成原电池。
(2)根据总反应式可知,锌是还原剂,失去电子。硫酸铜是氧化剂,得到电子,所以锌是负极,正极的金属性必须弱于锌的。由于铜离子在正极得到电子,所以电解质溶液是硫酸铜。
本题难度:一般