时间:2017-09-25 19:15:42
1、填空题 (12分)化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾并探究其性质。 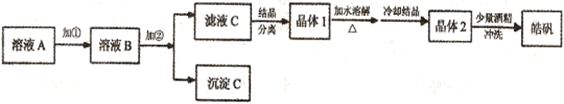 (l)制备皓矾的实验流程如下图所示。
(l)制备皓矾的实验流程如下图所示。
已知:下列氢氧化物开始生成沉淀到沉淀完全的pH范围分别为:
| | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Zn(OH)2 | 5.7 | 8.0 |
参考答案:(l)① 20%的H2O2(1分);Fe2+氧化为Fe3+,方便除杂(1分)
②ZnO或Zn(OH)2(各1分);Fe3++3H2O Fe(OH)3+3H+ ZnO+2H+= Zn2++H2O(2分)。③稀硫酸可抑制ZnSO4的水解,防止产生Zn(OH)2杂质(2分)
Fe(OH)3+3H+ ZnO+2H+= Zn2++H2O(2分)。③稀硫酸可抑制ZnSO4的水解,防止产生Zn(OH)2杂质(2分)
④防止晶体溶解,减少损失(2分)。
(2)取少量皓矾溶于水配制成溶液,往所得溶液中滴加几滴氯水,再加入适量KSCN溶液,如无明显现象说明不含Fe3+,如溶液变为红色则说明含Fe3+。(2分)
本题解析:(1)该制备流程首先为除去废液中的Fe杂质,然后得到含Zn2+的溶液,接着,就是结晶,溶解,结晶,洗涤。由沉淀PH范围可知,把Fe2+氧化成Fe3+,更方便除杂。加入试剂②调节pH,选用既可以达到这目的的,也要满足能不带进杂质。ZnSO4能够水解,故加入稀硫酸,利用同离子效应可以抑制水解,防止产生Zn(OH)2杂质。
(2)检验是否含有铁元素,可以取少量皓矾溶于水配制成溶液,往所得溶液中滴加几滴氯水,再加入适量KSCN溶液,如无明显现象说明不含Fe3+,如溶液变为红色则说明含Fe3+。
考点:Fe元素的除杂及防水解问题
点评:此题考核了利用调节PH来除杂的问题,要遵从不带进其他杂质的原则,同时要注意对于弱酸碱盐,要防止它的水解。
本题难度:困难
2、选择题 下列各组溶液中,微粒的物质的量浓度关系正确的是
A.0.1mol/L Na2CO3溶液:c(OH—) = c(HCO3—) + c(H+)+ c(H2CO3)
B.0.1mol/L NH4Cl溶液:c(NH4+)= c(Cl—)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO—)>c(H+)>c(OH—)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)= c(NO3—)
参考答案:D
本题解析:A.根据质子守恒,0.1mol/L Na2CO3溶液:c(OH—) = c(HCO3—) + c(H+)+ 2c(H2CO3),错误;B.NH4Cl是强酸弱碱盐,溶液显酸性:c(NH4+)< c(Cl—),错误;C.不符合电荷守恒,错误;D.根据物料守恒,正确;选D。
考点:考查微粒浓度的大小比较,溶液中的守恒关系等知识。
本题难度:困难
3、选择题 下列表示物质变化的化学用语正确的是
[? ]
 2H++CO32-
2H++CO32- Fe(OH)3+3H+
Fe(OH)3+3H+ H3O++S2-
H3O++S2- Al(OH)3+3H2S
Al(OH)3+3H2S 参考答案:B
本题解析:
本题难度:简单
4、选择题 下列各式中属于正确的水解反应的离子方程式的是
[? ]
A. CH3COOH + OH- CH3COO-+H2O
CH3COO-+H2O
B. S2-+2H2O H2S+2OH-?
H2S+2OH-?
C.CH3COOH+H2O CH3COO-+H3O+?
CH3COO-+H3O+?
D.NH4++H2O NH· H2O+H+?
NH· H2O+H+?
参考答案:D
本题解析:
本题难度:简单
5、实验题 某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol/L的MgCl2溶液中各加入10滴2 mol/L NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4 mL 2mol/LNH4Cl 溶液 | 沉淀溶解 |
| Ⅱ | 4 mL蒸馏水 | 沉淀不溶解 |
| 序号 | 实验内容 | 结 果 |
| 1 | 测定醋酸铵溶液的pH | pH约为7,溶液呈中性 |
| 2 | 取少量的相同质量的氢氧化镁分别盛放在试管中,分别向其中滴加醋酸铵溶液和氯化铵溶液 | 固体均溶解 |
参考答案:(1)NH4+ + H2O 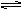 NH3·H2O + H+;(2)氯化铵中NH4+离子水解出的H+,与氢氧化镁电离出OH-离子生成了水;(3)①醋酸铵溶液呈中性,如果氢氧化镁能溶解于醋酸铵,说明是NH4+结合氢氧化镁电离出的OH-离子,导致沉淀溶解平衡移动正向移动,达到沉淀溶解; ② 1;(4)做对比分析,排除实验中溶剂水使沉淀溶解的可能性
NH3·H2O + H+;(2)氯化铵中NH4+离子水解出的H+,与氢氧化镁电离出OH-离子生成了水;(3)①醋酸铵溶液呈中性,如果氢氧化镁能溶解于醋酸铵,说明是NH4+结合氢氧化镁电离出的OH-离子,导致沉淀溶解平衡移动正向移动,达到沉淀溶解; ② 1;(4)做对比分析,排除实验中溶剂水使沉淀溶解的可能性
本题解析:(1)NH4Cl是强酸弱碱盐,NH4+水解NH4++H2O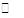 NH3·H2O+H+,c(H+)>c(OH-),溶液显酸性;(2)NH4Cl溶液显酸性,可能是氢氧化镁电离出的OH-与NH4+水解产生的H+发生反应,促使氢氧化镁溶解;(3)①醋酸铵溶液呈现中性,如果氢氧化镁溶解,说明是氢氧化镁电离出的OH-与NH4+结合成NH3·H2O,猜想1正确;如果氢氧化镁不溶解,说明猜想2正确,根据实验把氢氧化镁加入到醋酸铵溶液中,沉淀溶解,说明猜想1正确;(4)做对比实验,说明氢氧化镁不溶于水,溶于NH4Cl溶液,不是水的缘故。
NH3·H2O+H+,c(H+)>c(OH-),溶液显酸性;(2)NH4Cl溶液显酸性,可能是氢氧化镁电离出的OH-与NH4+水解产生的H+发生反应,促使氢氧化镁溶解;(3)①醋酸铵溶液呈现中性,如果氢氧化镁溶解,说明是氢氧化镁电离出的OH-与NH4+结合成NH3·H2O,猜想1正确;如果氢氧化镁不溶解,说明猜想2正确,根据实验把氢氧化镁加入到醋酸铵溶液中,沉淀溶解,说明猜想1正确;(4)做对比实验,说明氢氧化镁不溶于水,溶于NH4Cl溶液,不是水的缘故。
考点:考查盐类水解等相关知识。
本题难度:困难