时间:2017-09-25 19:14:58
1、选择题 下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO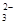 )+c(HCO
)+c(HCO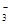 )]
)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=l0-amol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
A.①④
B.②⑤
C.①③
D.②④
参考答案:B
本题解析:①NaHCO3溶液加水稀释,促进HCO3-的水解,n(HCO3-)较小,n(Na+)不变,则c(Na+)/ c(HCO3-)的比值保持增大,故正确;②浓度均为0.1mol?L-1的Na2CO3、NaHCO3混合溶液,假设体积为1L,则n(Na+)=0.3mol,根据物料守恒可知c(CO32-)+c(HCO3-)+c(H2CO3)=0.2mol,故错误;③在0.1mol?L-1氨水中滴加0.1mol?L-1盐酸,刚好完全中和时pH=a,则溶液中由水电离出产生酸雾c(OH-)=c(H+)=10-amol?L-1,故正确;④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,抑制亚硫酸钠的水解,所以c(Na+)、c(SO32-?)均增大,故④正确;⑤在Na2S稀溶液中根据质子守恒可知c(H+)=c(OH?)?+?c(H2S)+c(HS-?),故⑤错误,答案选B。
考点:考查水的电离、溶液中离子浓度大小比较、盐类水解等
本题难度:一般
2、选择题 将AlCl3溶液和NaAlO2溶液分别蒸干并灼烧,所得产物主要成分为
A.都是Al(OH)3
B.前者是Al2O3,后者是NaAlO2
C.都是Al2O3
D.前者是AlCl3,后者是NaAlO2
参考答案:B
本题解析:
本题难度:困难
3、选择题 下列各组溶液中,微粒的物质的量浓度关系正确的是
A.0.1mol/L Na2CO3溶液:c(OH—) = c(HCO3—) + c(H+)+ c(H2CO3)
B.0.1mol/L NH4Cl溶液:c(NH4+)= c(Cl—)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO—)>c(H+)>c(OH—)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)= c(NO3—)
参考答案:D
本题解析:A.根据质子守恒,0.1mol/L Na2CO3溶液:c(OH—) = c(HCO3—) + c(H+)+ 2c(H2CO3),错误;B.NH4Cl是强酸弱碱盐,溶液显酸性:c(NH4+)< c(Cl—),错误;C.不符合电荷守恒,错误;D.根据物料守恒,正确;选D。
考点:考查微粒浓度的大小比较,溶液中的守恒关系等知识。
本题难度:困难
4、实验题 (1)(2分)甲同学在用FeSO4固体配制FeSO4溶液时,除了加入蒸馏水外,还需加 和 试剂(填化学式)
(2)(2分)乙同学为标定某醋酸溶液的准确浓度,用0.2000 mol·L—1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
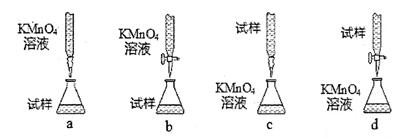
参考答案:8分
(1)(2分)Fe 稀硫酸 (2)(2分)0.2000mol/L
(3)b(2分)
滴入最后一滴KMnO4溶液,溶液恰好由无色变浅紫红色,且半分钟内不褪色(2分)
本题解析:(1)FeSO4溶液易被氧化、易水解,故还需要加Fe和稀硫酸。
(2)实验序号3误差较大,舍去,用1、2、4的数据进行计算,c(CH3COOH)×0.02=[(20.05+20.00+19.95)÷3] ×0.2,解得c(CH3COOH)= 0.2000(mol/L)。
(3)①KMnO4溶液成放在酸性的滴定管中,故b正确。
②KMnO4溶液呈紫色,故判断滴定终点的依据是滴入最后一滴KMnO4溶液,溶液恰好由无色变浅紫红色,且半分钟内不褪色。
考点:盐类的水解 中和滴定
点评:本题考查盐类的水解、中和滴定的知识,题目难度不大,本题注意根据硫酸亚铁和氢氧化亚铁的性质进行判断,注意把握实验的操作原理。
本题难度:一般
5、填空题 (12分)(1)物质的量浓度相同的三种盐NX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是 。
(2)比较下列溶液的pH(填“>”“<”或“=”):
①0.1 mol·L-1Na2CO3溶液 0.1 mol·L-1NaHCO3溶液
②0.1 mol·L-1NH4Cl溶液 0.01 mol·L-1NH4C1溶液
(3)把a、b、c、d四块金属片浸泡在稀H2SO4中,用导线两两相连,可以组成各种原电池。若a、b相连,a为负极;c、d相连,c极发生氧化反应;a、c相连,c为正极;b、c相连,电流由c极流向b极,则这四种金属的活动性由强到弱的顺序为 。
(4)将AlCl3溶液蒸干、灼烧,最后所得的固体的主要成份是 。
(5)氯化铁溶液呈 性(填“酸”、“碱”或“中”),原因是(用离子方程式表示):
(6)向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,溶液的pH 7(填“>”“<”或“=”),离子反应总方程式为: 。
参考答案:(1)HX>HY>ZH;(2)① > ②> ;(3)a >b>c>d ;(4) Al2O3。(5)酸性,Fe3++3H2O Fe(OH)3+3H+;(6) < ,Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O。
Fe(OH)3+3H+;(6) < ,Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O。
本题解析:(1)物质的量浓度相同的三种盐,pH越大,说明酸根离子水解越是强烈,对应的酸越弱,所以HX、HY、HZ的酸性由强到弱的顺序为HX>HY>HZ;(2)①同浓度的Na2CO3和NaHCO3溶液,CO32-水解程度大于 HCO3-所以0.1 mol·L-1Na2CO3溶液的pH>0.1 mol·L-1NaHCO3溶液的pH,②不同浓度的NH4Cl溶液,浓度越小,NH4+水解程度越大,但是水解后溶液的酸性越弱。所以②0.1 mol·L-1NH4Cl溶液的pH<0.01 mol·L-1NH4C1溶液的pH;(3)组成各种原电池。若a、b相连,a为负极;活动性a>b,c、d相连,c极发生氧化反应为负极,活动性c>d;a、c相连,c为正极, a>c,b、c相连,电流由c极流向b极,活动性b>c,综上:a >b>c>d;(4) AlCl3溶液蒸干得到氢氧化铝,灼烧得到氧化铝。(5) 氯化铁溶液呈酸性,因为Fe3+水解,Fe3++3H2O Fe(OH)3+3H+;(6)向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,发生的反应如下Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O.得到的是NaAlO2溶液,溶液的pH<7。
Fe(OH)3+3H+;(6)向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,发生的反应如下Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O.得到的是NaAlO2溶液,溶液的pH<7。
考点:考查盐类的水解的应用和金属活动性比较。
本题难度:困难