时间:2017-09-25 19:10:42
1、选择题 4.下列电离方程式中正确的是
A.NaHCO3溶于水:NaHCO3=Na++H++CO32-
B.NaHSO4熔化:NaHSO4=Na++H++SO42-
C.HF溶于少量水中:2HF H++HF2一
H++HF2一
D.(NH4)2 SO4溶于水:(NH4)2 SO4=2NH4++SO42一
参考答案:D
本题解析:A项NaHCO3溶于水:NaHCO3=Na++HCO3- ;B项NaHSO4熔化:NaHSO4=Na++HSO4- ;C项HF溶于少量水中:HF H++F一。
H++F一。
考点:电离方程式的书写
点评:本题为简单题,主要考察了电离方程式的书写,但要注意电荷守恒和原子守恒,
本题难度:一般
2、填空题 (4分)写出下列物质的电离方程式:
(1)NaHSO4溶于水_______________________________________________________
(2) H2S的电离________________________________________________________
参考答案:(4分) (1)? NaHSO4 = Na++H++SO42-? (2) H2S 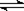 ?H+ + HS-? HS-
?H+ + HS-? HS-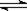 ?H++S2-
?H++S2-
本题解析:略
本题难度:简单
3、选择题 从植物花中可提取一种简写为HIn的有机物,在水溶液中因存在以下电离平衡,故可用作酸碱指示剂。
HIn(aq,红色)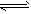 H++In-(aq,黄色),在浓度为0.02 mol·L-1的下列各溶液(1)HCl、(2)Na2O2、
H++In-(aq,黄色),在浓度为0.02 mol·L-1的下列各溶液(1)HCl、(2)Na2O2、
(3)NaCl(aq)、(4)NaHSO4(aq)、(5)NaHCO3(aq)、(6)氨水中加入该指示剂,其中能使指示剂显黄色的是
[? ]
A.(1)(4)(5)
B.(2)(6)
C.(1)(4)
D.(5)(6)
参考答案:D
本题解析:
本题难度:一般
4、选择题 在体积都为1L,pH=2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是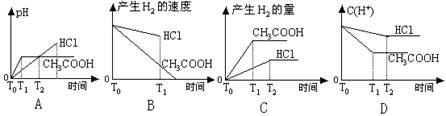
参考答案:C
本题解析:很多学生错选了A选项或D选项 PH=2的盐酸,其浓度为0.01 mol/L,则PH=2的醋酸,由于电离度只有1%,则醋酸浓度1mol/L
A错误的原因为:起始时PH不等于2
B中图像盐酸和醋酸标位颠倒了
D中盐酸是强酸,C(H+)的浓度下降速率快,斜率大,最终达到平衡,
正确图像如下: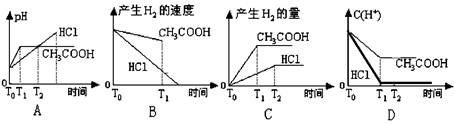
本题难度:一般
5、选择题 下列离子方程式正确的是(?)
A.亚硫酸钠与盐酸反应:Na2SO3+2H+===2Na2++SO2↑+ H2O
B.碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
C.稀硫酸与锌反应:H2SO4+Zn=Zn2+ +SO42-+H2↑
D.硫酸溶液与氢氧化钠溶液反应:H++ OH-==H2O
参考答案:D?
本题解析:书写离子方程式时易溶于水且易电离的物质写离子,把单质、氧化物、气体、弱酸、弱碱和水等难电离物质和难溶物质用化学式表示,A中亚硫酸钠应写成离子形式,B中碳酸钙为难溶物质应写化学式,C中稀硫酸应写离子形式。D中硫酸溶液与氢氧化钠均应写离子形式
本题难度:一般