时间:2017-09-25 19:07:12
1、选择题 下列化合物可以由两种单质直接化合而成的是
A.FeCl2
B.SO2
C.SO3
D.NO2
参考答案:B
本题解析:铁与氯气反应生成FeCl3,A选项错误.硫与氧气反应生成二氧化硫,B选项正确、C选项错误.氮气与氧气化合生成NO,D选项错误.
本题难度:简单
2、选择题 X、Y两元素能形成多种化合物,已知化合物X2Y中,X和Y的质量比为7:5,则?X?和Y?质量比符合7:15的化合物是
A.XY2
B.X2Y3
C.X3Y2
D.X2Y5
参考答案:B
本题解析:分析:根据X2Y化合物中,X和Y的质量比为7:5,即2X:Y=7:5,进行分析符合质量比为7:15的化合物的化学式.
解答:根据X2Y化合物中中,X和Y的质量比为7:5,即2X:Y=7:5;
设符合质量比为7:15的化合物的化学式为:XAYB,则 AX:BY=7:15;
解得: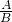 =
=
由此可知:X?和Y?质量比符合7:15的化合物:X2Y3 ;
故选:B.
点评:本题主要考查了物质中各元素质量的比值,难度不大,根据所学知识即可完成.
本题难度:一般
3、选择题 有四种物质:①金刚石、②白磷、③甲烷、④四氯化碳,其中分子具有正四面体构型的是
A.①②③
B.①③④
C.②③④
D.①②③④
参考答案:C
本题解析:金刚石中不存在分子,故有①的都不对,排除后选C。要注意P4(白磷)分子的键角为60°而不是109°28′。
本题难度:困难
4、选择题 下列叙述中错误的是
A.在离子晶体中不可能存在非极性键
B.含有阳离子的晶体中,不一定含有阴离子
C.在共价化合物的分子晶体中,只能含有共价键
D.在原子晶体中不可能存在极性共价键
参考答案:AD
本题解析:Na2O2属离子晶体,其中含有非极性键;SiO2属原子晶体,其中含有极性共价键。
本题难度:困难
5、选择题 下列说法中正确的是
A.氢键是一种特殊的化学键,它广泛地存在于自然界中
B.P4和CH4都是正四面体分子且键角都为109o28ˊ
C.有分子构成的物质中一定含有共价键
D.形成共价键的元素不一定是非金属元素
参考答案:D
本题解析:
本题难度:简单