时间:2017-09-25 19:05:50
1、计算题 绿矾(FeSO4·7H2O)硫酸法生产一种稀有金属产品过程中产出的副产品,产品外观为淡绿色或淡黄绿色结晶固体。加入适量可调节碱性水中的pH,与水中悬浮物有机结合,并加速沉淀,主要应用于水质净化和工业废水处理,同时具有杀菌作用。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为?(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为?(填>、<、=")40%" 。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为?。?
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200 mL 2 mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+=6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+=3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+= NO↑+3Fe3++2H2O
① V值范围?;
② 若V=48,试计算混合物中CuS的质量分数?(保留两位小数)。
参考答案:(1)7.14 mol·L-1? ; >(各2分)?(2)0.77(2分)?
(3)FeSO4·Fe2(SO4)3·10H2O (3分) (4)①42~60mL(3分);②0.33或1/3(3分)
本题解析:(1)密度为1.4g/cm3,50%的硫酸物质的量浓度为:
c= =7.14 mol·L-1,
=7.14 mol·L-1,
50%的硫酸与30%的硫酸等体积(假设羰基为1,密度分别是ρ1和ρ2)混合,混合酸的浓度为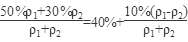 >40%。
>40%。
(2)因为20%发烟硫酸为80克H2SO4含SO3 20克,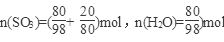 ,
,
若用SO3·nH2O表示20%的发烟硫酸,则n=0.77。
(3)配制溶液加入足量的BaCl2溶液,过滤得沉淀9.32克,n(SO42-)=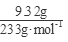 =0.04mol;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化(2Fe2++Cl2==2Fe3++2Cl-),n(Fe2+)=2×
=0.04mol;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化(2Fe2++Cl2==2Fe3++2Cl-),n(Fe2+)=2×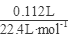 =0.01mol;由电荷守恒n(Fe3+)=0.02mol, 7.32克晶体含有0.01molFeSO4为1.52g、0.01mol Fe2(SO4)3为4.00g,还有H2O为1.80g即0.1mol,晶体的化学式FeSO4·Fe2(SO4)3·10H2O。
=0.01mol;由电荷守恒n(Fe3+)=0.02mol, 7.32克晶体含有0.01molFeSO4为1.52g、0.01mol Fe2(SO4)3为4.00g,还有H2O为1.80g即0.1mol,晶体的化学式FeSO4·Fe2(SO4)3·10H2O。
(4)假设固体混合物全部为CuS,则n(CuS)=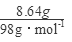 =0.09mol,需要硝酸的物质的量为y,
=0.09mol,需要硝酸的物质的量为y,
8NO3-+3CuS? +? 8H+==3Cu2++3SO42-+8NO↑+4H2O,
3? 8
0.09mol?y
y=0.24mol
剩余的硝酸的物质的量为:0.4mol-0.24mol=0.16mol。
0.112mol硝酸和(NH4)2Fe(SO4)2溶液完全反应。
NO3-+3Fe2++4H+==NO↑+3Fe3++2H2O
3mol? 4
1×10-3VL×2mol/L 0.16mol,解得V=60,
所以V值范围为:42<V<60,
②若V=48,与48mL(NH4)2Fe(SO4)2溶液完全反应需要硝酸的物质的量为:
NO3-+3Fe2+? +? 4H+→NO↑+3Fe3++2H2O
3mol? 4
0.048L×2mol/L? n
解得:n=0.128mol,
故与固体混合物反应的硝酸的物质的量为:0.4mol-0.128mol=0.272mol,
设Cu2S的物质的量xmol,CuS的物质的量为ymol,160x+96y=8.64g①.
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
3? 16
x? 16x/3
8NO3-+3CuS+8H+→3Cu2++3SO42-+8NO↑+4H2O,
3?8
y ?8y/3
16x/3+8y/3=0.272②
由①②解得:x=0.036; y=0.03
混合物中CuS的质量分数为: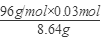 ×100%≈33.33%。
×100%≈33.33%。
本题难度:一般
2、填空题 铜是重要的金属材料.
(1)工业上可用Cu2S和O2反应制取粗铜,化学方程式为?,该反应中氧化剂为________?.
(2)在100 mL 18 mol·L-1浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4<________mol.
(3)电子工业曾用30%的FeCl3溶液腐蚀覆盖铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得FeCl3溶液,设计如下实验流程.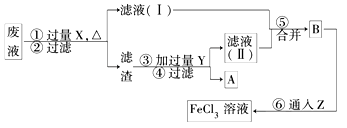
上述流程中,所加试剂的化学式为:
X________________,Y____________,Z____________;
第⑥步反应的离子方程式为___________________________?
参考答案:(1)Cu2S? +? O2 =2Cu? +? SO2? O2? ,.Cu2O?(2)0.9
(3) X? Fe? Y? HCl? Z? Cl2? 2Fe 2+ + Cl2 ==? 2Fe 3+ + 2Cl-
本题解析:(1)根据物质的组成可知,生成物除铜以外,还与SO2生成,所以反应的方程式是Cu2S? +? O2 =2Cu? +? SO2;根据方程式可知,氧元素和铜元素的化合价都是降低的,所以氧化剂是O2和Cu2O。
(2)由于在反应过程中,硫酸的浓度逐渐降低,而稀硫酸和铜是不反应的,所以被还原的硫酸小于0.9mol。
(3)溶液中还原氯化铜、氯化铁、氯化亚铁,所以首先加入足量的铁粉置换出铜,即X是铁。由于铁过量,所以在金属混合物中加入盐酸溶解铁,过滤、洗涤干燥即得到铜,因此Y是盐酸。要把氯化亚铁变成氯化铁,则需要通入氯气,则Z是氯气,反应的离子方程式是2Fe 2+ + Cl2 ="=" 2Fe 3+ + 2Cl-。
本题难度:一般
3、选择题 产于台湾海峡的红珊瑚在中国是吉祥富有的象征,一直用来制做珍贵的工艺品.据分析其红色是因为含某种元素的氧化物,试推测该元素是( )
A.Na
B.Mg
C.Fe.
D.Ca
参考答案:C
本题解析:
本题难度:一般
4、实验题 铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下: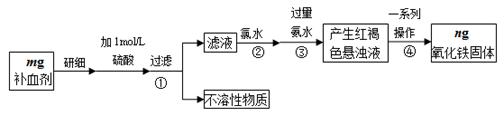
(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol·L-1的硫酸溶液,则配制时用到的仪器除烧杯、500mL容量瓶外,还需要?。
(2)步骤②加入过量氯水后发生反应的离子方程式为?。
(3)步骤④中一系列操作步骤为???、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为?。
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加? _______________溶液,溶液变红说明该补血剂已部分变质。向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有?性(填“氧化”或“还原”)的物质。
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是?。
A.KSCN溶液
B.酸性KMnO4溶液
C.铁粉
D.FeCl3溶液
参考答案:(1)玻璃棒、胶头滴管?(2)2Fe2+ + Cl2 = 2Fe3+ + 2Cl-?(3)过滤?
(4)70n/m % (5)KSCN?还原性?(6)B
本题解析:(1)物质的量浓度的溶液在配制时使用的仪器有烧杯、玻璃棒、胶头滴管、500 mL的容量瓶、量筒。(2)在步骤②加入过量氯水把Fe2+氧化为Fe3+.发生反应的离子方程式为2Fe2++Cl2 =2Fe3++ 2Cl-.(3)在步骤④中将Fe(OH)3过滤出来,洗涤干净,然后灼烧,冷却至室温后称量就得Fe2O3的质量。(4)根据Fe守恒可由Fe2O3的质量计算出药品中铁元素的质量,进而计算出Fe元素的质量分数。{(ng÷160g/mol) ×2×56g/mol}÷m×100%="70n/m" %.(5)Fe3+的检验方法是向待测溶液中加入KSCN溶液,若溶液变为血红色,则证明溶液中含有Fe3+.向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有还原性的物质。(6)为了检验(5)中滤液中是否有Fe2+应该选用的试剂是酸性KMnO4溶液。现象为溶液的紫色变浅或褪色。选项为B。4·7H2O)中Fe元素的含量的测定及物质的量浓度的溶液的配制、混合物的分离方法、Fe3+的检验等知识。
本题难度:一般
5、选择题 下列试剂中可用于鉴别Fe2+和Fe3+的是(?)
①NaOH溶液②酸性KMnO4溶液③KSCN溶液④KI淀粉溶液
A.①③
B.①②③
C.①③④
D.①②③④
参考答案:D
本题解析:略
本题难度:简单