时间:2017-09-25 18:54:07
1、选择题 下列每组的三种物质中,两边的固体均有导线连接,插入中间的液体中,其中能组成原电池的是
A.Zn | H2SO4(稀) | C
B.Cu | 酒精 | Ag
C.Zn | CCl4 | Cu
D.Fe | H2SO4(稀) | Fe
参考答案:A
本题解析:
分析:根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解:A、具备原电池的构成条件,所以能组成原电池,故A正确.
B、乙醇是非电解质,且不能自发的进行氧化还原反应,故B错误.
C、四氯化碳是非电解质,且不能自发的进行氧化还原反应,故C错误.
D、两电极活泼性相同,故D错误.
故选A.
本题难度:简单
2、选择题 用导线把锌片与铜片连接好,然后平行插入稀硫酸中(如图所示),下列说法正确的是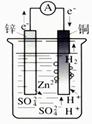
A.铜是负极
B.铜片上无气泡产生
C.锌是负极
D.铜片的质量逐渐减少
参考答案:C
本题解析:略
本题难度:简单
3、选择题 用酸性氢氧燃料电池电解硫酸钠饱和溶液的装置如图所示?(a、b为铜电极).下列说法中不正确的是( )
A.电池工作时,正极反应式为:O2+4H++4e-=2H2O
B.电解时,当阴极逸出amol气体,同时有W克Na2SO4﹒10H2O析出,保持温度不变,剩余溶液中的硫酸钠的质量分数是
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.02gH2时,b极周围会产生0.02gH2
参考答案:A、左边装置是氢氧燃料电池,所以是原电池;原电池放电时,正极上氧化剂得电子发生还原反应,即氧气得电子和氢离子反应生成水,电极反应式为O2+4H++4e-=2H2O,故A正确.
B、电解时,阴极上析出的是氢气,当阴极逸出amol气体电解的水的质量为:
2H2O?电解?.?O2↑+2H2↑,
36g? 2mol
18ag?amol
所以当阴极逸出amol气体电解的水的质量为18ag,电解后的溶液仍为饱和溶液,溶液的质量分数为:142142+180×100%×WW+18a×100%=71W161(W+18a)×100%,故B错误.
C、电子在导线中移动,不能在溶液中移动,故C错误;
D、燃料电池和电解池中转移的电子数是相等的,当电池中消耗0.02gH2,根据电极反应:H2→2H++2e-,所以转移电子0.02mol,b极的电极反应为:2H++2e-→H2,转移电子0.02mol,会产生0.02gH2,故D正确.
故选BC.
本题解析:
本题难度:简单
4、选择题 在右图所示的原电池中,下列说法不正确的是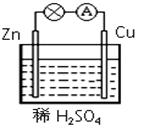
A.溶液中的H+向Cu电极移动
B.正极发生还原反应
C.电子由锌片经电解质溶液流向铜片
D.负极反应为 Zn - 2e- Zn2+
Zn2+
参考答案:C
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,铜是正极,溶液中的氢离子在正极得到电子,因此选项ABD都是正确的,选项C是错误的,答案选C。
点评:该题是基础性试题的考查,主要是检验学生对原电池原理的熟悉了解程度,意在巩固学生的基础知识,提高学生灵活运用基础知识解决实际问题的能力,难度不大,记住原电池工作原理,灵活运用即可。
本题难度:一般
5、选择题 下列说法不正确的是
A.用电解法精炼粗铜的时候纯铜做阳极
B.将镁块与钢铁输水管相连,可以防止钢铁腐蚀
C.熔融烧碱的时候,不能使用石英坩埚
D.可以用硫酸或者CO2中和碱性废水
参考答案:A
本题解析:A、用电解法精炼粗铜的时候粗铜做阳极,精铜做阴极,错误;B、镁活泼性强于铁,让铁做原电池的正极得到保护,正确;C、石英坩埚的主要成分二氧化硅与碱反应,正确;D、硫酸或者CO2都能与碱性废水反应,正确。
本题难度:一般