时间:2017-09-25 18:39:31
1、填空题 (8分)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:(按照要求用 a、 b 、c表示)
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是______________。
(3)当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是________________。
(4)若三者c(H+)相同时,物质的量浓度由大到小的顺序是________________。
(5)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是____________。
(6)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为________,反应所需时间的长短关系是_________
(7)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是_________________。
参考答案:21、(1)b>a >c ; (2) b>a ="c" ;(3)c >a > b (4) c >a > b
(5)c >a = b (6)a =" b=" c a =" b" < c (7)c >a = b
本题解析:①氯化氢和硫酸是强电解质,在水中完全电离,盐酸是一元酸,所以盐酸中c(H+)=c(HCl),硫酸是二元酸,硫酸溶液中c(H+)=2c(H2SO4),醋酸是一元弱酸,所以醋酸溶液中c(H+)<c(CH3COOH),所以等物质的量浓度的三种酸,氢离子浓度大小顺序是b>a>c;
②同体积同物质的量浓度的三种酸,三种酸n(HCl)=n(CH3COOH)=n(H2SO4),盐酸和醋酸是一元酸,硫酸是二元酸,盐酸和醋酸需要氢氧化钠的物质的量相等,硫酸需要的氢氧化钠是盐酸和醋酸的2倍,中和NaOH能力由大到小的顺序是b>a=c;
③氯化氢和硫酸是强电解质,在水中完全电离,盐酸是一元酸,所以盐酸中c(H+)=c(HCl),硫酸是二元酸,硫酸溶液中c(H+)=2c(H2SO4),醋酸是一元弱酸,所以醋酸溶液中c(H+)<c(CH3COOH),所以等物质的量浓度的三种酸,氢离子浓度大小顺序是b>a>c,氢离子浓度越大,水的电离程度越小,三种溶液中水的电离程度由大到小的顺序是c >a > b;
④氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以如果氢离子浓度相等时,物质的量浓度由大到小的顺序为c>a>b;
⑤氯化氢和硫酸是强电解质,完全电离,醋酸是弱电解质部分电离,当三者c(H+)相同时,醋酸的浓度大于盐酸,所以当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积醋酸最多,由大到小的顺序是c >a = b
⑥与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,当c(H+)相同、体积相同时,同时加入形状、质量、密度相同的锌,则开始时反应速率的大小关系是a=b=c,;随着反应的进行,弱酸继续电离,化学反应速率加快,若产生相同体积的H2,反应所需时间短,反应所需时间的长短关系是a =" b" < c;
⑦强酸溶液稀释100倍,氢离子浓度变为原来的1/100,,弱酸溶液稀释10倍,氢离子浓度变为大于原来的1/100,盐酸和硫酸是强酸,醋酸是弱酸,所以c(H+)由大到小的顺序为c>a=b。
考点:考查弱电解质的电离,化学反应速率,溶液的稀释,PH值等知识。
本题难度:一般
2、填空题 (8分)体积相同、物质的量浓度均为0.1 mol·L-1的①盐酸、②醋酸两种溶液,pH:①________②(填“>”、“<”或“=”,下同);与完全相同的镁条发生反应,开始时的反应速率:①______ ②; 中和等量NaOH时消耗的体积:①________②;与足量的Zn反应生成H2的物质的量:① ________②。
中和等量NaOH时消耗的体积:①________②;与足量的Zn反应生成H2的物质的量:① ________②。
参考答案:<? >?=?=
本题解析:盐酸是强酸,而醋酸是弱酸,存在电离平衡。所以物质的量浓度相等的盐酸和醋酸,其中的酸性强,pH小。与镁的反应速率快。由于盐酸和醋酸的物质的量浓度是相等的,所以中和等量的氢氧化钠消耗的体积是相同的。体积和物质的量浓度都相同,所以盐酸和醋酸的物质的量也是相同的,因此产生的氢气是相等的。
本题难度:简单
3、选择题 下列电离方程式书写正确的是( )
A.H2S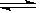 2H++S2-
2H++S2-
B.Al(OH)3==Al3+ + 3OH-
C.NH3·H2O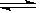 NH4+ +OH-
NH4+ +OH-
D.NaHCO3 ==Na++ H+ + CO32-
参考答案:C
本题解析:略
本题难度:一般
4、选择题 下列不能证明一元酸HA为弱酸的是(?)
A.NaA溶液的pH>7(室温下)
B.pH试纸显示0.1 mol/L HA溶液的pH为2~3(室温下)
C.0.1 mol/L的HCl和HA溶液,前者的导电能力明显更强
D.HA溶液能与CH3COONa溶液反应生成CH3COOH
参考答案:D
本题解析:室温下,强碱弱酸盐由于水解,其溶液的pH>7,故A能够证明一元酸HA为弱酸,故A不能选;若一元酸HA为强酸,则0.1 mol/L HA溶液的pH在室温下应该为1,而用pH试纸显示0.1 mol/L HA溶液的pH为2~3,说明HA为弱酸,故B不能选;0.1 mol/L的HCl和HA溶液,前者的导电能力明显更强,这可以说明一元酸HA为弱酸,故C正确;HA溶液能与CH3COONa溶液反应生成CH3COOH,只能说明HA的酸性比醋酸强,但是否为弱酸还不能确定,故D为本题的正确答案。
点评:本题考查了怎样判断一个酸为弱酸,属于对基础知识的考查,本题难度不大。
本题难度:简单
5、填空题 (7分)下图为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线,试回答: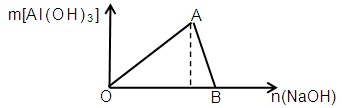
(1) A点时已参加反应的AlCl3和NaOH的物质的量之比是?
(2) OA段曲线所表示的反应的离子方程式是?
(3) AB段曲线所表示的反应的离子方程式是?
(4) B处溶液中存在的浓度最大的离子是?(填离子符号)。向B处于生成的溶液中通入CO2,可见到的现象是?
参考答案:(7分)
⑴ 1:3(1分)
⑵ Al3++3OH-==Al(OH)3↓(2分)
⑶ Al(OH)3+OH―==AlO2-+2H2O (2分)
⑷ Na+ ; 生成白色沉淀(各1分)
本题解析:略
本题难度:一般