时间:2017-09-25 18:30:56
1、选择题 配位化合物的数量巨大,组成和结构形形色色,丰富多彩。请指出配合物 [Cu(H2O)4](OH)2的中心离子、配体、中心离子的电荷数和配位数
A.Cu2+、H2O、+2、4
B.Cu+、H2O、+1、4
C.Cu2+、OH-、+2、2
D.Cu2+、H2O、+2、2
参考答案:A
本题解析:考查配位键的形成与有关判断。根据化学式可知,水分子提供孤对电子,所以水是配体,配位数是4;铜离子接受孤对电子,属于中心离子,因此正确的答案选A。
本题难度:一般
2、选择题 下列叙述正确的是( )
A.离子化合物可能含共价键
B.共价化合物可能含离子键
C.单质中一定不含共价键
D.离子化合物中一定含有金属离子
参考答案:A
本题解析:
本题难度:简单
3、选择题 如图为元素周期表短周期的一部分.关于A~G七种元素的叙述正确的是( )
A.E、F、G形成的单质中都含有共价键
B.形成的简单阴离子半径:E>C>D
C.B、C、D三种元素的氢化物的稳定性依次减弱
D.A、B、E的氢化物都能跟HNO3发生化合反应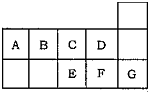
参考答案:图为元素周期表短周期的一部分,根据元素在周期表中的位置,可推断出A为C元素,B为N元素,C为O元素,D为F元素,E为S元素,F为Cl元素,G为Ar元素,
A.E、F、G形成的单质分别为:S、Cl2、Ar,Ar为单原子分子,不存在共价键,故A错误;
B.C、D、E的阴离子分别为:O2-、F-、S2-,其中O2-、F-核外有2个电子层,S2-有3个电子层,则S2-半径大于O2-、F-,根据核外电子排布相同的离子,核电核数越大半径越小判断离子半径,则有O2->F-,故S2->O2->F-,故B正确;
C.元素的非金属性越强,对应氢化物的稳定性就越大,非金属性B<C<D,B、C、D三种元素的氢化物的稳定性依次增强,故C错误;
D.A、B、E的氢化物分别是CH4、NH3、H2S,只有NH3能与硝酸化合,故D错误;
故选B.
本题解析:
本题难度:一般
4、选择题 下列物质中含有共价键的离子化合物是
[? ]
A.KOH?
B.MgCl2?
C.CO2?
D.CH4
参考答案:A
本题解析:
本题难度:简单
5、选择题 下列化合物分子内只有共价键的是( )
A.BaCl2
B.NaOH
C.(NH4)2SO4
D.H2SO4
参考答案:D
本题解析:
本题难度:简单