时间:2017-09-25 18:30:13
1、选择题 关节炎病原因是在关节滑液中形成尿酸钠晶体:HUr(尿酸)+H2O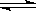 Ur﹣(尿酸根离子)+H3O+? Ur﹣(溶液)+Na+(溶液)
Ur﹣(尿酸根离子)+H3O+? Ur﹣(溶液)+Na+(溶液)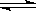 NaUr(固)
NaUr(固)
第一次关节炎发作大部分在寒冷季节脚趾和手指的关节处。下列叙述不正确的是
A?尿酸酸性比盐酸弱? B?尿酸钠的溶解度随温度升高而增大
C?反应①为吸热反应,②为放热反应? D?尿酸钠的熔点很低。
参考答案:D
本题解析:根据反应式可知,尿酸存在电离平衡,电离是吸热的,属于弱酸,A、C正确。节炎发作大部分在寒冷季节,说明尿酸钠熔点比较高,所以选项D是错误的。答案选D。
本题难度:一般
2、选择题
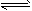 2AB3(g)。当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率是
2AB3(g)。当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率是 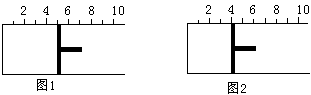
参考答案:B
本题解析:
本题难度:一般
3、选择题 恒温、恒压下,a mol A和b mol B在一个容积可变的容器中发生如下反应:
A(g)+2B(g) 2C(g)
2C(g)
一段时间后达到平衡,生成n mol C。则下列说法正确的是(?)
A.物质A、B的转化率之比为a∶b
B.起始时刻和达平衡后容器中的压强比为(a+b)∶(a+b-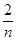 )
)
C.若起始时放入2a mol A和2b mol B,则达平衡时生成2n mol C
D.当v正(A)=2v逆(B)时,可确定反应达平衡
参考答案:C
本题解析:生成n mol C参加反应的A、B的物质的量分别为n/2 mol,n mol,转化率之比为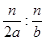 =
=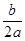 ;恒压过程,压强之比为1∶1;恒压过程成倍地增大反应物的量,则平衡时C的量也成倍地增加;反应速率之比等于化学计量数比,当2v正(A)=v逆(B)时,可确定反应达到平衡。
;恒压过程,压强之比为1∶1;恒压过程成倍地增大反应物的量,则平衡时C的量也成倍地增加;反应速率之比等于化学计量数比,当2v正(A)=v逆(B)时,可确定反应达到平衡。
本题难度:简单
4、选择题 下列叙述正确并能用勒沙特列原理解释的是
A.FeCl3+3NH4SCN Fe(SCN)3+3NH4Cl溶液显红色,加少量NH4Cl固体后颜色变浅
Fe(SCN)3+3NH4Cl溶液显红色,加少量NH4Cl固体后颜色变浅
B.红棕色NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
参考答案:B
本题解析:加少量NH4Cl固体后颜色变浅,说法错误,应为颜色不变。红棕色NO2加压后颜色先变深后变浅,据2 NO2 N2O4加压平衡向生成N2O4方向移动故加压气体体积变小NO2浓度增大颜色变深继而平衡移动颜色随之变浅正确。催化剂对平衡无影响。H2、I2、HI平衡混和气加压后颜色变深,H2+ I2
N2O4加压平衡向生成N2O4方向移动故加压气体体积变小NO2浓度增大颜色变深继而平衡移动颜色随之变浅正确。催化剂对平衡无影响。H2、I2、HI平衡混和气加压后颜色变深,H2+ I2 2HI知加压对该平衡无影响,但加压气体体积缩小有色I2蒸气浓度增大故颜色变深。
2HI知加压对该平衡无影响,但加压气体体积缩小有色I2蒸气浓度增大故颜色变深。
本题难度:一般
5、填空题 向某密闭容器中加入0.3mol A、0.1mol C和一定量的气体B三种气体,在一定条件下发生反应,各物质浓度随时间变化如下面左图所示。下面右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况且t2—t5四个阶段都各改变一种条件,所用条件均不同。t3—t4阶段为使用催化剂。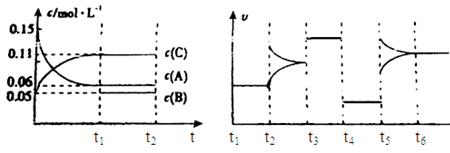
(1)若t1=15s,则t0—t1阶段以C浓度变化表示的反应速率为v(C)=?mol/(L?s);
(2)若t2—t3阶段,C的体积分数变小,此阶段v正?v逆(填“大于”、“小于”或“等于”)
(3)B的起始物质的量为?mol;
(4)t1时刻,平衡常数K=?;
(5)t5—t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为a KJ,写出该反应的热化学方程式?;
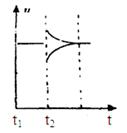
(6)若t2时刻后图像变化如下图,则改变条件为? ?
?
a.恒温恒压下,按照2:1比例充入任意量的B和C
b.恒温恒压下,加入0.24mol A、0.06mol B和0.14mol C
c.恒温恒压下,加入0.12mol A、0.1mol B和0.22mol C
d.恒温恒压下,加入0.14mol B和0.30mol C
参考答案:(1)0.004(2)小于(3)0.04(4)2.80
(5)3A(g) B(g)+2C(g)?ΔH=+100a kJ?mol-1(6)bd
B(g)+2C(g)?ΔH=+100a kJ?mol-1(6)bd
本题解析:(1)若t1=15s,生成物C在t0~t1时间段的平均反应速率v=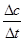 =
=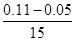 mol/(L?s)=0.004mol/(L?s);(2)由题意知,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,如t4~t5阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应速率不相等,则t4~t5阶段应为减小压强;反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,则该反应中气体的化学计量数之和前后相等,则有:3A(g)
mol/(L?s)=0.004mol/(L?s);(2)由题意知,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,如t4~t5阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应速率不相等,则t4~t5阶段应为减小压强;反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,则该反应中气体的化学计量数之和前后相等,则有:3A(g) B(g)+2C(g),若t2—t3阶段,C的体积分数变小,说明反应向逆反应方向进行,则v正<v逆;(3)根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为
B(g)+2C(g),若t2—t3阶段,C的体积分数变小,说明反应向逆反应方向进行,则v正<v逆;(3)根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为 =2L,生成B的物质的量为0.03mol/L×2L=0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol;(4)在t1时刻,c(A)=0.06 mol/L,c(B)=0.05 mol/L,c(C)=0.11 mol/L,故平衡常数K=
=2L,生成B的物质的量为0.03mol/L×2L=0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol;(4)在t1时刻,c(A)=0.06 mol/L,c(B)=0.05 mol/L,c(C)=0.11 mol/L,故平衡常数K= =
=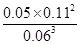 =2.80;(5)反应的方程式为3A(g)
=2.80;(5)反应的方程式为3A(g) B(g)+2C(g),A的物质的量减少0.03mol,而此过程中容器与外界的热交换总量为akJ,则A的物质的量减少3mol,与外界的热交换总量为100akJ,根据图象可知t5~t6阶段应为升高温度,A的物质的量减少,说明反应向正反应方向移动,则正反应吸热,故该反应的热化学方程式为3A(g)
B(g)+2C(g),A的物质的量减少0.03mol,而此过程中容器与外界的热交换总量为akJ,则A的物质的量减少3mol,与外界的热交换总量为100akJ,根据图象可知t5~t6阶段应为升高温度,A的物质的量减少,说明反应向正反应方向移动,则正反应吸热,故该反应的热化学方程式为3A(g) B(g)+2C(g),△H=+100akJ?mol-1;(6)恒温恒压下反应图像变化达到平衡,一种反应速率瞬间减小,一种瞬间增大,最后达到平衡,3A(g)
B(g)+2C(g),△H=+100akJ?mol-1;(6)恒温恒压下反应图像变化达到平衡,一种反应速率瞬间减小,一种瞬间增大,最后达到平衡,3A(g) B(g)+2C(g),则a不符,d符合,c不符,b符合
B(g)+2C(g),则a不符,d符合,c不符,b符合
本题难度:一般