时间:2017-09-25 18:08:33
1、填空题 将锌片和铜片以下图所示两种方式分别插入同浓度稀硫酸中。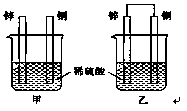
(1)以下叙述中,正确的是?(填标号)。
A.装置甲、乙中铜片表面均无气泡产生
B.装置甲、乙中稀硫酸的浓度均减小
C.装置乙中锌片是正极,铜片是负极
D.装置乙中产生气泡的速率比装置甲快
(2)装置乙中,总反应的离子方程式为 ?;若导线上通过0.2 mol电子,消耗锌的质量为 ?g。
2、填空题 (6分)用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。这个原电池的负极是 ,电极反应式是 ;
正极是 ,电极反应式是 。
3、填空题 铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)FeCl3溶液的PH值_____7(填 >、 =、< ),其原因是(用离子方程式表示)_______________;实验室配置FeCl3溶液时,通常将FeCl3固体溶于浓盐酸中,再加水稀释,用你学过的化学原理来解释其原因
_________________。
(2)FeCl3溶液腐蚀印刷电路铜板的化学方程式是:2FeCl3 + Cu = 2FeCl2 + CuCl2。将该反应设计成原电池。请画出原电池的装置图,标出正、负极和电子流动的方向电极材料有:石墨、铜片、铁片;
①画出装置图______________
②正极反应式____________;负极反应式_______________。
4、填空题 请利用氧化还原反应Fe?+?2FeCl3?=?3FeCl2?设计一个原电池。 ?
负极:_______________正极:________________?
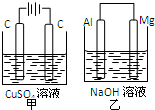
5、选择题 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当电路中通过的电子都是0.1mol时,下列说法正确的是( )
A.溶液的质量变化:甲减小乙增大
B.溶液pH值变化:甲减小乙增大
C.相同条件下产生气体的体积:V甲=V乙
D.电极反应式:甲中阴极:Cu2++2e-=Cu,乙中负极:Mg-2e-=Mg2+