时间:2017-09-25 18:05:19
1、填空题 (16分)(1)某课外活动小组同学用下图装置进行实验
试回答下列问题:
①若开始时开关K与a连接,则铁发生电化学腐蚀中的 腐蚀。
②若开始时开关K与b连接,则总反应的离子方程式为 。
(2)芒硝化学式为Na2SO4·10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如下图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”) 导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因: 。
④若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为 ,已知H2的燃烧热为285.8 kJ·mol-1,则该燃料电池工作产生36 g H2O时,理论上有 kJ的能量转化为电能。
参考答案:(16分)每空2分(1)①吸氧 ②2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(2)①4OH--4e-===2H2O+O2↑ 小于 ②D ③H+放电促进水的电离,使OH-浓度增大
④H2-2e-+2OH-==2H2O 571.6
本题解析:(1)①如果开关K与a连接,则构成原电池。NaCl溶液为中性,因此发生吸氧腐蚀,正极上氧气得电子发生还原反应;
②如果K与b连接,则构成电解池。铁与电源的负极相连,Fe作阴极,溶液中的氢离子放电。石墨作阳极,溶液中的氯离子放电,因此电解的总离子反应为2Cl-+2H2O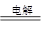 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(2)①电解时,阳极上失电子发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,所以阳极上氢氧根离子失电子被氧化生成水和氧气,电极反应式为4OH--4e-=2H2O+O2↑;电解池中阴离子向阳极移动,阳离子向阴极移动,因此硫酸根离子向阳极移动,钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数;
②氢氧化钠在阴极生成,所以在D口导出;
③电解时阴极上氢离子放电生成氢气,氢离子来自于水的电离,所以促进水的电离,导致溶液中氢氧根离子的浓度大于氢离子的浓度,溶液的pH值增大;
④燃料原电池中,燃料在负极上失电子发生氧化反应,氧化剂在正极上得电子发生还原反应,该燃料原电池中,氧气是氧化剂,氢气是还原剂,氢氧化钠作为电解质,溶液显碱性,则负极电极反应式为H2-2e-+2OH-==2H2O;36g水的物质的量是36g÷18g/mol=2mol,消耗2mol氢气。由于H2的燃烧热为285.8 kJ·mol-1,则理论上有285.8 kJ·mol×2=571.6kJ的热量转化为电能。
考点:考查原电池和电解池原理
本题难度:困难
2、选择题 下图中两电极上发生的电极反应如下:a极:2H++2e-===H2↑,b极:Cu-2e-== Cu 2+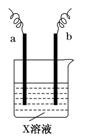
下列说法不正确的是
A.X溶液的pH增大
B.该装置可能是将化学能转化为电能
C.该装置一定是电解池
D.a和b可能是同种电极材料
参考答案:B
本题解析:a极:2H++2e-===H2↑消耗氢离子,故PH增大,A正确;铜不能与氢离子反应置换氢气,故该反应不是自发的氧化还原反应,不能设计成原电池,故该装置只能设计成电解池,B错误,C正确;电解池的阳极为铜电极,阴极可以是铜也可以是其他导电的物质,故D正确,答案选B.
考点:电解池的反应原理
本题难度:一般
3、填空题 (14分)(1)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)_________?______。
(2)乙烷中含有乙烯除杂试剂为?;
反应的化学方程式为?。
(3)在10L密闭容器中充入2molA和1molB,发生的化学反应:3A(g)+B(g)  ?C(g)
?C(g)
+2D(g),2min后反应达到平衡,在相同温度下,测得平衡时容器内气体的压强是反应前的5/6,试填写下列空白:
①用气体B表示的2min内的平均反应速率为?。
②平衡时,A的浓度为?mol/L。
(4)我国拥有完全自主产权的氢氧燃料电池车在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。电池负极反应为?,
正极反应?。
参考答案:(1)Ⅰ>Ⅲ>Ⅱ?(2)溴水? CH2==CH2 + Br2→CH2Br-CH2Br?(3)①0.025mol/L.min?②0.05
(4)H2-2e-+2OH- ==2H2O? O2+4e—+2H2O==4OH-
本题解析:略
本题难度:简单
4、选择题 在理论上可用来设计原电池的反应是
A.Fe +2HCl =FeCl2+ H2
B.NaOH +HCl=NaCl+H2O
C.Cu SO4 +2NaOH= Cu(OH)2+Na2 SO4
D.Ca CO3+2HCl=CaCl2+ H2O+ CO2
参考答案:A
本题解析:试题分析:常温能自发进行的氧化还原反应可设计成原电池,有元素化合价变化的反应为氧化还原反应,以此来解答。A中反应是置换反应,属于氧化还原反应,能用于设计原电池,A正确;B中反应是中和反应、C和D中都是复分解反应,反应中没有元素的化合价变化,不是氧化还原反应,因此不能用于设计原电池,故BCD均不符合题意,因此答案选A。
考点:考查原电池设计的有关判断
点评:该题是高考中的常见题型,属于基础性试题的考查,侧重对学生基础知识的巩固和训练。明确能自发进行的氧化还原反应能设计成原电池是解答本题的关键,准确判断出反应中有关元素的化合价变化是前提。
本题难度:简单
5、选择题 铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如图所示。下列说法正确的是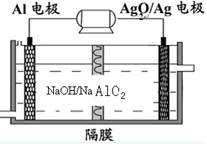
A.电池负极反应式2Ag+2OH--2e-=" Ag" 2O+H2O
B.放电时电池负极附近PH减小
C.电池总反应式2Al+3Ag2O+6H+ =2Al3++6Ag+3H2O
D.电解液中Na+通过隔膜由右向左移动
参考答案:B
本题解析:该装置是原电池,铝活泼作负极,电极反应为Al-3e-+4OH-═AlO2-+2H2O,AgO为正极,正极上的电极反应式为AgO+2e-+H2O═Ag+2OH-,故总反应为2Al+3AgO+2NaOH═2NaAlO2+3Ag+H2O;放电时负极区消耗OH-,pH减小;负极区消耗OH-,正极生成OH-,故OH-从负极移向正极,该隔膜应为阴离子交换膜,Na+不能通过。
本题难度:一般