时间:2017-09-25 18:02:50
1、选择题 下列判断正确的是
A.在水电离出来的c(H+)=1×10-13mol/L的溶液中Fe3+、NH4+、NO一定不能大量共存
B.AlCl3溶液蒸干后得到的固体是AlCl3
C.在0.1 mol/L CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.pH=3的醋酸溶液跟pH=11的氢氧化钡溶液等体积混合后,溶液pH=7
参考答案:C
本题解析:A、该溶液可能为酸性也可能为碱性,在酸性溶液中可以共存;
B、氯化铝在加热过程中,水解程度增大,且生产HCl挥发,故最终得到三氧化二铝;
C、该等式为质子守恒,正确;
D、醋酸为弱酸,混合后醋酸过量,溶液呈酸性。
本题难度:一般
2、选择题 常温下,pH=10的X、Y两种碱溶液各1 mL,分别稀释到100 mL,其pH与溶液体积(V) 的关系如图所示,下列说法正确的是
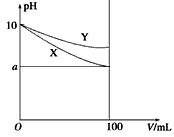
[? ]
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列事实能说明乙酸(CH3COOH) 属于弱酸的是
①1mol/L CH3COOH的 pH=2 ②乙酸能与水以任意比互溶
③20mL 1mol/L CH3COOH 与20mL 1mol/LNaOH恰好中和 ④CH3COONa溶液的pH>7
A.①②
B.②③
C.③④
D.①④
参考答案:D
本题解析:① 1mol/L CH3COOH的 pH=2,说明CH3COOH未完全电离,是弱电解质;乙酸能与水以任意比互溶只是CH3COOH的溶解性,和强弱电解质没关系;20mL 1mol/L CH3COOH 与20mL 1mol/LNaOH恰好中和只是酸碱中和体现不出乙酸(CH3COOH) 属于弱酸;CH3COONa溶液的pH>7,是因为CH3COO—水解CH3COO—+H2O CH3COOH+OH—,故乙酸(CH3COOH) 属于弱酸;则D项正确。
CH3COOH+OH—,故乙酸(CH3COOH) 属于弱酸;则D项正确。
考点:弱电解质电离及盐类水解应用。
本题难度:一般
4、填空题 I.利用含锰废水(主要含Mn2+、SO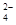 、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下: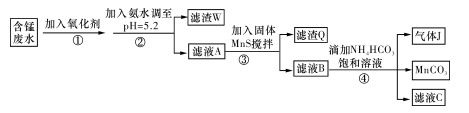
已知某些物质完全沉淀的pH如下表: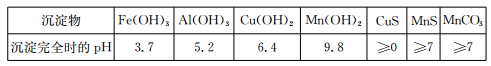
回答下列问题:
(1)过程②中,所得滤渣的主要成分是?。
(2)过程③中,发生反应的离子方程式是?。
(3)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3的反应的离子方程式是?。
(4)由MnCO3可制得重要的催化剂MnO2:2MnCO3+O2=2MnO2+2CO2。
现在空气中加热460.0 g MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是?(用百分数表示,小数点后保留1位)。
Ⅱ.常温下,浓度均为0.1 mol/L的下列六种溶液的pH如下表: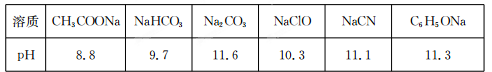
(1)上述盐溶液中的阴离子,结合H+能力最强的是?。
(2)根据表中数据判断,浓度均为0.0l mol/L的下列物质的溶液中,酸性最强的是
(填序号)。
A.HCN?B.HC1O? C.C6H5OH? D.CH3 COOH? E.H2 CO3
(3)据上表数据,请你判断下列反应不能成立的是?(填序号)。
A.HCN+ Na2 CO3=NaHCO3+NaCN
B.CH3 COOH+NaCN=CH3 COONa+HCN
C.CO2 +H2O+2C6 H5ONa=Na2 CO3 +2C6 H5OH
D.CH3 COONa+HClO=NaClO十CH3 COOH
参考答案:I.(1)Fe(OH)3,Al(OH)3
(2)MnS + Cu2+ = Mn2+ + CuS
(3)Mn2++2HCO3- =MnCO3 +CO2↑+H2O
(4)78.6%
II.(1)CO32-;(2)D;(3)CD。
本题解析:I.(1)调节pH在5.2,由题意知Fe2+和Al3+均以Fe(OH)3和Al(OH)3沉淀状态存在;(2)加入MnS是为了使其中Cu2+产生CuS沉淀除去,故搅拌目的是使MnS 与 Cu2+快速、充分反应,离子方程式MnS + Cu2+ = Mn2+ + CuS↓;(3)由题意知Mn2+和加入的HCO3-反应,产生CO2气体和MnCO3沉淀,故离子方程式Mn2++2HCO3- =MnCO3 +CO2↑+H2O;(4)MnCO3受热分解为MnO,MnO部分氧化为MnO2,产品中杂质有MnO,460.0 gMnCO3,物质的量为4mol,受热产生4molMnO,设产生MnO2物质的量为xmol,即有xmolMnO氧化,剩余MnO为(4-x)mol,产物的总质量为(4-x)mol×71g·mol-1+xmol×87g·mol-1=332g,x=3,则MnO2的质量分数=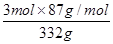 ?=78.6%。
?=78.6%。
II.(1)对应酸的酸性越弱,其阴离子越易水解,其阴离子结合质子能力越强,根据表格中数据可知CO32-结合质子能力最强;(2)对应酸的酸性越弱,其阴离子越易水解,其盐溶液碱性越强,所以PH最小的酸性最强,所以CH3COOH酸性最强,故答案为D;(3)复分解反应中,碱性强的物质置换碱性弱的物质,酸性强的物质置换酸性弱的物质,根据以上知识对各选项进行判断即可;故答案为CD。
本题难度:困难
5、简答题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 | HA物质的量浓度 (mol?L-1) | NaOH物质的量浓度 (mol?L-1) | 混合溶液的pH 甲 0.2 0.2 pH=a 乙 c 0.2 pH=7 丙 0.2 0.1 pH>7 丁 0.1 0.1 pH=9 |
参考答案:(1)一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度都为0.2mol/L,则酸碱的物质的量相等,如a=7,说明反应后溶液呈中性,则HA是强酸,如a>7,反应后呈碱性,则HA是弱酸,
故答案为:a=7为强酸,a>7为弱酸;
(2)反应后溶液呈中性,如HA为强酸,则c=0.2,如HA为弱酸,则c>0.2,仅从乙组情况分析,c不一定等于0.2,
由于反应后溶液呈中性,则有c(OH-)=c(H+),根据溶液呈中性,则有c(Na+)+c(H+)=c(A-)+c(OH-),
所以c(A-)=c(Na+),故答案为:否;c(A-)=c(Na+);
(3)等物质的量的酸碱反应后溶液呈碱性,由于NaOH为强碱,则该酸为弱酸,在溶液中存在A-+H2O?HA+OH-,则
c(Na+)>c(A-),溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)>c(A-)>c(OH-)>c(H+),
故答案为:弱;c(Na+)>c(A-)>c(OH-)>c(H+);
(4)溶液的pH=9,则氢离子浓度为10-9 mol/L,等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,c(OH-)=Kwc(H+)=10-1410-9=10-5 mol/L,
一元酸HA和NaOH溶液等体积混合生成NaA溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),
依据上述计算得到:c(Na+)-c(A-)=c(OH-)-c(H+)=10-5-10-9;?
依据溶液中电荷守恒和物料守恒得到:c(Na+)+c(H+)=c(OH-)+c(A-),c(Na+)=c(A-)+c(HA),合并得到c(OH-)-c(HA)=c(H+)=10-9 ,
故答案为:10-5;10-5-10-9;10-9.
本题解析:
本题难度:一般