时间:2017-09-25 17:57:01
1、填空题 在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如下图,据图回答下列问题: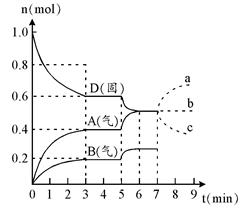
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为?。
(2)根据右图写出该反应的化学方程式?。
(3)第5分钟时,升高温度,A、B、D的物质的量变化如右图,则该反应是?(填“放热”或“吸热”)反应。若在第7分钟时增加D的物质的量,A的物质的量变化正确的是_____(用图中a~c的编号回答)
(4)某同学在学习了“化学反应速率和化学平衡”专题后,发表如下观点,你认为错误的是?。
a.化学反应速率理论是研究怎样在一定时间内快出产品
b.化学反应速率理论是研究怎样提高原料转化率
c.化学平衡理论是研究怎样使用有限原料多出产品
d.正确利用化学反应速率和化学平衡理论都可以提高化工生产的综合效益
参考答案:(1)0.067mol/(L·min)?(2分,单位不写扣1分)
(2)2D(s)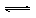 2A(g) + B(g)?(2分,状态不写不扣分)
2A(g) + B(g)?(2分,状态不写不扣分)
(3)吸热、b?(各1分);?(4)b? 1分?(共7分)
本题解析:略
本题难度:简单
2、填空题 (12分)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示 _________?,K值大小与温度的关系是:温度升高,K值_____________?。(填一定增大、一定减小、或可能增大也可能减小)。
(2) 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K=??,升高温度,K值??(填“增大”、“减小”或“不变”)。
②在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)=??。
③据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_________________________(用化学方程式表示)。
参考答案:(12分)
(1) 可逆反应的进行程度越大?可能增大也可能减小?
(2) ①K= ;?减小。?②
;?减小。?②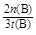 mol·(L·min)-1。
mol·(L·min)-1。
③Cu2O+CO 2Cu+CO2
2Cu+CO2
本题解析:本题考查了化学平衡移动的基本知识与技能。
(2)①由图像可知,升高温度,产物的量减小,即平衡左移,K值减小,正反应是放热反应。②v=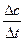 =
= =
=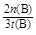 mol·(L·min)-1
mol·(L·min)-1
本题难度:一般
3、选择题 中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2和CO2。下列对此反应的叙述中正确的是
A.使用光催化剂不改变反应速率
B.使用光催化剂能增大NO的转化率
C.升高温度能加快反应速率
D.改变压强对反应速率无影响
参考答案:C
本题解析:考查外界条件对反应速率和平衡的影响。催化剂只能改变反应速率,但不能改变平衡状态,选项A、D都不正确;升高温度移动加快反应速率,选项C正确;有气体参加或生成的反应,改变压强,可以改变反应速率,选项D不正确,答案选C。
本题难度:一般
4、填空题 (1)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
①pH增大能加速O3分解,表明对O3分解起催化作用的是_________________。
②据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填代号)
a. 40°C、pH=3.0? b. 10°C、pH=4.0? c. 30°C、pH=7.0
(2)向一容积为2升的密闭容器中充入2molA、0.6molC和一定量的B三种气体,一定条件下发生某种反应。现有两个图像分别对该反应的情况进行描述:
图1表示各物质的浓度随时间的变化情况,其中t0~t1阶段c(B)未画出;
图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件(其中t2改变的条件是加入某种催化剂);(说明:图1中实线表示反应进程)
①你认为t3时改变的条件是?(填写“加压”或“减压”),B的起始物质的量为?mol;
②各阶段平衡时对应的平衡常数如下表所示:
| 时间段 | t1~t2 | t2~t3 | t3~t4 | t5~t6 |
| 平衡常数 | K1 | K2 | K3 | K4 |
 ?CH3OH(g)反应合成甲醇。
?CH3OH(g)反应合成甲醇。| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |

参考答案:(1)①(1分)OH-;②(2分)b a c
(2)①(1分)减压?(2分)1.0
②(1分)K1 =K2=K3 >K4
③(2分)2A(g)+B(g) 3C(g)?△H="△H=" —a?kJ·mol-1(a>0)
3C(g)?△H="△H=" —a?kJ·mol-1(a>0)
(3)①(2分)80% ,(1分)<
②氧气(1分)? CH3OH - 6e- + 8OH - ="=" CO3 2-?+?6H2O (2分)
本题解析:(1)①pH增大,说明OH-的浓度增大,这表明对O3分解起催化作用的是OH-;②50°C、pH=3.0,O3的浓度减少一半所需的时间31min,即 40°C、pH="3.0" ,O3的浓度减少一半所需的时间大于31min,而30°C、pH=6.0,O3的浓度减少一半所需的时间为15min,所以30°C、pH=6.0,O3的浓度减少一半所需的时间小于15min,故O3的分解速率按依次增大的顺序为b a c;(2)①t3时,正逆反应都同时减少,所以t3时改变的条件是减压,根据图1可以知道,A的物质的量的浓度减小了0.2mol/L,C增加了0.3mol/L,故B为反应物,且B的物质的量减少0.1mol/L,所以B起始物质的量为(0.4+0.1)×2=1.0mol,②该反应的化学方程式为
2A+B 3C,t4为升高温度所致,有图可以知道,温度升高逆反应的变化程度大于正反应的程度,所以该反应为放热反应,催化剂不可以改变化学平衡,温度不变平衡常数不变,所以K1、K2、K3、K4之间的关系为K1 =K2=K3 >K4,此条件下该反应的热化学方程式为2A(g)+B(g)
3C,t4为升高温度所致,有图可以知道,温度升高逆反应的变化程度大于正反应的程度,所以该反应为放热反应,催化剂不可以改变化学平衡,温度不变平衡常数不变,所以K1、K2、K3、K4之间的关系为K1 =K2=K3 >K4,此条件下该反应的热化学方程式为2A(g)+B(g) 3C(g)?△H= —a?kJ·mol-1(a>0);(3)①CO(g) + 2H2(g)?
3C(g)?△H= —a?kJ·mol-1(a>0);(3)①CO(g) + 2H2(g)? ?CH3OH(g),某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)= 0.1 mol/L,则CO的转化率=(1-0.1×2)/1×100%=80% ,
?CH3OH(g),某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)= 0.1 mol/L,则CO的转化率=(1-0.1×2)/1×100%=80% ,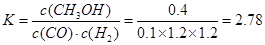 ,该反应为放热反应,因为表中的数据为温度越大,K越小,所以该温度小于250℃;②从图可以看出,电子从b流向a,所以a为正极,b为负极,即a通入的是氧气,b通入的为甲醇,b处电极上发生的电极反应是:
,该反应为放热反应,因为表中的数据为温度越大,K越小,所以该温度小于250℃;②从图可以看出,电子从b流向a,所以a为正极,b为负极,即a通入的是氧气,b通入的为甲醇,b处电极上发生的电极反应是:
CH3OH -6e- +8OH -=CO3 2-?+?6H2O。
点评:本题考查了化学平衡、原电池,该题考查的知识面比较广,综合性强,有一定的难度。
本题难度:一般
5、选择题 (10分)(1)已知可逆反应:M(g)+N(g) P(g)+Q(g)?ΔH>0,
P(g)+Q(g)?ΔH>0, 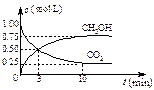
若要增大Q的浓度,在其它条件不变的情况下可以采取的措施为?(填序号)。
A.加入一定量M? B.降低反应温度? C.升高反应温度?
D.缩小容器体积? E.加入催化剂? F.分离出一定量P
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)?△H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)?△H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)?△H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________?。
(3)在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g)? ΔH=-49.0 kJ/mol, 测
CH3OH(g)+H2O(g)? ΔH=-49.0 kJ/mol, 测
得CO2和CH3OH(g)的浓度随时间变化如右图所示。
①从3 min到10 min,v(H2)=?mol/(L·min)。
②能说明上述反应达到平衡状态的是?(选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是?(选填编号)。
A.升高温度? B.恒温恒容充入He(g)
C.将H2O(g)从体系中分离? D.恒温恒容再充入1 mol CO2和3 mol H2
参考答案:(1)A C D F(2分)
(2)CO(g)+FeO(s)= Fe(s) + CO2(g)?△H=?-218.00kJ·mol-1(2分)
(3)? ①0.11或 ②D? ③CD?(每空2分)
②D? ③CD?(每空2分)
本题解析:略
本题难度:简单