时间:2017-09-25 17:54:30
1、选择题 19世纪门捷列夫的突出贡献是( )
A.提出了原子学说
B.提出了分子学说
C.发现了稀有气体
D.发现了元素周期表
参考答案:A.道尔顿提出了近代原子学说,故A错误;
B.阿佛加德罗提出了分子学说,故B错误;
C.莱姆赛发现了稀有气体,故C错误;
D.1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,故D正确.
故选D.
本题解析:
本题难度:简单
2、推断题 a、b、c、d、e为短周期主族元素。其中
①a和b属同周期元素,二者能形成多种气态化合物;
②a和c属同周期元素,二者能形成两种气态化合物;
③a和d属同主族元素,二者能形成两种常见化合物;
④e可分别和a、b、c、d形成具有相同电子数的共价化合物甲、乙、丙、丁。
请回答:
(1)a元素为_________,甲的分子式为__________ ,丁的电子式为____________。
(2)由上述一种或几种元素形成的物质可与水发生氧化还原反应,写出一个符合要求的化学反应方程式:___________ 。
(3)a单质和丙可形成燃料电池(以KOH溶液为电解质)。该燃料电池的负极反应式为_____________。
(4)乙是一种液态火箭燃料,在O2中燃烧,产物无污染。常温下,6.4g乙燃烧放出Q kJ热量,该反应的热化学方程式为_________________。
参考答案:(1)氧(或O); H2O2?;
(2)3NO2+ H2O== 2HNO3 + NO(或 C + H2O(g) CO+H2、C+H2O(g)
CO+H2、C+H2O(g) CO2+H2等)
CO2+H2等)
(3) C2H6 + 18OH - - 14e-== 2CO32- + 12H2O
(4)N2H4(1) +O2(g)= N2(g)+2H2O(l);△H= -5Q kJ/mol
本题解析:
本题难度:一般
3、选择题 下列关于元素周期表与元素周期律的说法正确的是( )
A.元素周期表有十八个纵行,所以有十八个族
B.短周期元素指第四、五、六周期的元素
C.第ⅠA族的元素全部是金属元素
D.元素性质的周期性变化是元素原子核外电子排布周期性变化的必然结果
参考答案:A.元素周期表共有7个主族、7个副族、1个零族、1个第Ⅷ族,第8、9、10三列为第Ⅷ族,共有16个族,故A错误;
B.短周期元素指第一、二、三周期的元素,不含过渡元素,四、五、六周期为长周期,故B错误;
C.ⅠA族包含氢元素与碱金属元素,碱金属都是金属元素,但氢元素是非金属性元素,故C错误;
D.原子结构中核外电子排布的周期性变化而引起元素的性质呈周期性变化,则元素的性质呈周期性变化的根本原因是核外电子排布的周期性变化,故D正确;
故选D.
本题解析:
本题难度:简单
4、简答题 如表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
| ? H | ? | ? | ? | ? | ? | ? | He |
| ? | ? | ? | ? | ? | A | B | ? |
| C | ? | D | ? | E | F | G | ? |
参考答案:(1)G为Cl,质子数为17,电子层数为3,最外层电子数为7,原子结构示意图为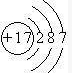
,故答案为:
;
(2)A、B、E、F、G五种元素中F的非金属性最强,则形成的气态氢化物HF最稳定,故答案为:HF;
(3)C为Na,原子结构中有3个电子层,最外层电子数为1,则在元素周期表中的第三周期第ⅠA族,故答案为:ⅠA;
(4)F、G元素的非金属性为Cl>S,则Cl的最高价氧化物对应水化物的酸性强,该酸为HClO4,故答案为:HClO4;
(5)C为Na,B为F,形成离子化合物,其电子式为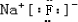
,故答案为: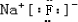
.
本题解析:
本题难度:一般
5、选择题 下列微粒半径大小的比较正确的是( )
A.Na+<Mg2+<Al3+<O2-
B.S2-<Cl-<Na+<Al3+
C.Na<Mg<Al<S
D.Cs>Rb>K>Na
参考答案:A、Na+、Mg2+、Al3+、O2-都具有相同的电子层结构,核电荷数越大,微粒半径越小,即微粒半径由大到小的顺序是:
O2->Na+>Mg2+>Al3+,故A错误;
B、S2-和Cl-具有相同的电子层结构,核电荷数越大,微粒半径越小,即微粒半径由大到小的顺序是:r(S2-)>r(Cl-),同理r(Na+)>r(Al3+),但Cl-比Na+多一个电子层,显然r(Cl-)>r(Na+),故离子半径大小是:S2->Cl->Na+>Al3+,故B错误;
C、Na、Mg、Al、S的电子层数相同,核电荷数越大,半径越小,即:Na>Mg>Al>S,故C错误;
D、Cs、Rb、K、Na的最外层电子数相同,电子层数逐渐减少,其原子半径Cs>Rb>K>Na,故D正确.
故选D.
本题解析:
本题难度:简单