时间:2017-09-25 17:43:06
1、选择题 温度为T时,向4L恒容密闭容器中充入2.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g),经一段时间后达到平衡.反应过程中测定的部分数据见下表.
| t/s | 0 | 50 | 150 | 250 | 350 n(PCl3)/mol 0 0.32 0.38 0.40 0.40 |
参考答案:A、由表中数据可知,平衡时n(PCl3)=0.4mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则n′(PCl3)=0.11 mol/L×4L=0.44mol,说明升高温度平衡正向移动,正反应为吸热反应,即△H>O,故A错误;
B、由表中数据可知50s内,△n(PCl3)=0.32mol,v(PCl3)=0.32mol4L50s=0.0016mol/(L?s),故B错误;
C、对于可逆反应:PCl5(g)?PCl3(g)+Cl2(g),
开始(mol/L):0.5? 0? 0
变化(mol/L):0.1? 0.1? 0.1
平衡(mol/L):0.4? 0.1? 0.1
所以平衡常数k=0.1×0.10.4=0.025.
起始时向容器中充入2.0?mol?PCl5、0.40?molPCl3和0.40?molCl2,起始时PCl5的浓度为0.5mol/L、PCl3的浓度为0.1mol/L、Cl2的浓度为0.1mol/L,浓度商Qc=0.1×0.10.5=0.02,K>Qc,说明平衡向正反应方向移动,反应达平衡前v(正)>v(逆),故C正确;
D、等效为起始加入4.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于0.8mol,即相同温度下,起始时向容器中充入4.0?mol?PCl3、和4.0?mol?Cl2,达到平衡时,PCl3的物质的量小于0.8mol,参加反应的PCl3的物质的量大于3.2mol,故达到平衡时,PCl3的转化率高于80%,故D错误.
故选C.
本题解析:
本题难度:简单
2、选择题 已知:4NH3+?5O2 4NO+?6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)
4NO+?6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)
(mol L-1
L-1 min-1)表示,则正确的关系是
min-1)表示,则正确的关系是
A.?4/5(NH3)=v(O2)
B.?5/6(O2)=v(H2O)
C.?2/3(NH3)=v(H2O)
D.?4/5(O2)=v(NO)
参考答案:D
本题解析:
本题难度:简单
3、选择题 一定温度下,反应2SO2+O2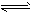 2SO3达到平衡时,n(SO2)︰n(O2) ︰n(SO3) ===2︰3︰4。缩小体积,反应再次达到平衡时,n(O2) =0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
2SO3达到平衡时,n(SO2)︰n(O2) ︰n(SO3) ===2︰3︰4。缩小体积,反应再次达到平衡时,n(O2) =0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
[? ]
A.0.4mol
B.0.6mol
C.0.8mol
D.1.2mol
参考答案:A
本题解析:
本题难度:一般
4、计算题 工业制硫酸时,利用催化氧化反应将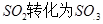 是一个关键的步骤。
是一个关键的步骤。
(1)某温度下,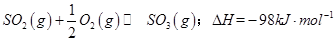 。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
(2)一定条件下,向一带活塞的密闭容器中充入2mol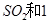 mol
mol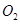 ,发生反应:
,发生反应: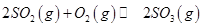 ,达平衡后改变下述条件,
,达平衡后改变下述条件,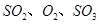 气体平衡浓度都比原来增大的是____________(填字母)。
气体平衡浓度都比原来增大的是____________(填字母)。
A.保持温度和容器体积不变,充入2mol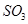
B.保持温度和容器体积不变,充入2molN2
C.保持温度和容器内压强不变,充入1mol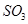
D.移动活塞压缩气体
E.升高温度
(3)下列关于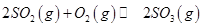 反应的图像中,不正确的是_________。
反应的图像中,不正确的是_________。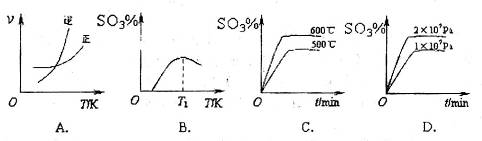
(4)同学们学习了电化学知识后大家提出,可以用电解的方法来生产硫酸,可避免产生酸雨,污染环境。于是大家设计了一个以铂为电极,两极分别通入SO2和空气,酸性电解液来实现电解生产硫酸。
①阳极的电极反应为______________________________。
②若电解液为2L0.025mol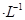 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。
③设计此实验的想法得到了老师的充分肯定,但与工业上生产硫酸相比还是有很多不足,请对此实验进行合理的评价____________________________(写出一点即可)。
参考答案:(每空2分)
(1)10/3或3.33
(2)A、D
(3)C
(4)2SO2 – 4e? + 4H2O = 2SO42? +8H+? 1.12L? 1
耗费大量的电能,不经济;产率低,不能大规模生产
本题解析: (1)转化的SO2为:196kJ÷98kJ?mol?1=2mol,根据三行式计算:
SO2? + 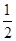 O2?
O2?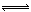 ?SO3
?SO3
初始浓度(mol?L?1)? 0.04? 0.1? 0
转化浓度(mol?L?1)? 0.02? 0.01? 0.02
平衡浓度(mol?L?1)? 0.02? 0.09? 0.02
可得平衡常数K=0.02÷(0.02×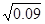 =10/3
=10/3
(2)A、增加SO3,平衡逆向移动,三者浓度都增大;B、N2与反应无关,三者浓度都不变;C、保持压强不变,充入SO3,根据等效平衡原理,三者浓度不变;D、加压后各物质的浓度都大于原平衡;E、升高温度,平衡逆向移动,SO2、O2浓度增大,SO3浓度减小。
(3)A、温度升高,平衡逆向移动,逆反应速率增加的倍数大,正确;B、图像的前半段为反应建立平衡的过程,SO3%逐渐增大,T1之后的阶段为化学反应随温度的升高平衡移动的过程,升高温度,平衡逆向移动SO3%逐渐减小,图像正确;C、600℃高于500℃,平衡逆向移动,SO3%逐渐减小,图像错误;D、增大压强,平衡正向移动,SO3%增大,图像正确。
(4)①阳极上发生失电子反应,SO2失电子生成SO42?。
②V(SO2) =0.1mol÷2×22.4L/mol=1.12L;
pH=-lg(0.1mol×2÷2L)=1
③电解需要消耗大量的电能,所以本设计耗费大量的电能,不经济;产率低,不能大规模生产。
本题难度:困难
5、选择题 密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示。已知v(A)、v(B)、v(C)之间有以下关系2 v(B) = 3 v(A)、2 v(C) = v(A)。则此反应可表示为
[? ]
A.3A+2B=6C
B.2A+3B=2C
C.2A+3B=C
D.3A+2B=2C
参考答案:C
本题解析:
本题难度:简单