时间:2017-09-25 17:42:04
1、选择题 25℃时,a?mol?L-1一元酸HA与b?mol?L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是( )
A.a=b
B.a>b
C.c?(A-)=c(Na+)
D.c?(A-)<c(Na+)
2、选择题 在常温下,下列各组溶液的c(H+)一定等于1×10-7mol/L的是( )
A.pH=2和pH=12的两种溶液以等体积混合
B.0.10mol/L?H2SO4与0.10mol/L?NaOH溶液以等体积混合
C.将pH=5的CH3COOH溶液稀释100倍
D.pH=1的H2SO4与0.05mol/L?的Ba(OH)2溶液以等体积混合
3、选择题 室温时,向20mL?0.1mol/L的醋酸溶液中不断滴入0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述正确的是( )
A.a点时:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
B.b点时:c(Na+)=c(CH3COO-)
C.c点时:c(H+)=c(CH3COOH)+c(OH-)
D.d点时:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)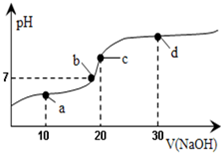
4、选择题 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
A.a点表示溶液中c(CH3COO-)约为10-3mol/L
B.b点表示的溶液中c(Na+)>c(CH3COO-)
C.c点表示CH3COOH和NaOH恰好反应完全
D.d点表示的溶液中
| c(CH3COO-)?c(H+) c(CH3COOH) |

5、选择题 保健医生提示:胃酸过多的人,应少食苹果,那么苹果汁的pH( )
A.大于7
B.等于7
C.小于7
D.无法判断