时间:2017-09-25 17:29:08
1、实验题 某同学为了探究碳酸的酸性强弱,设计了如图所示的装置。 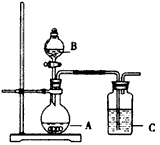
(1)A为碳酸钙,B为浓醋酸,C为硅酸钠溶液,实验现象:C中产生白色胶状沉淀。由此可得出结论:醋酸的酸性比碳酸的酸性强。你认为这个结论合理吗?_____,原因是______________________,改进的方法是__________________。
(2)少量CO2与硅酸钠溶液反应。对其除硅酸沉淀外的反应产物,不同的同学持有不同的观点:甲同学认为是碳酸钠、乙同学认为是碳酸氢钠。请设计一个简单的实验验证:__________。
(3)若A为NaHCO3,B为稀硫酸,C为漂白粉溶液,实验现象为:C中产生白色沉淀。文献资料的观点是,该实验能证明碳酸比次氯酸的酸性强。小明则认为该实验不能证明碳酸一定比次氯酸的酸性强。他的理由是_______________。本实验告诉我们:在保存漂白粉时要注意的事项是________________。
(4)在常温下高锰酸钾能将浓盐酸氧化成Cl2。若将A 改为KMnO4,B为浓盐酸,C为淀粉KI溶液,______ (填“能”或“不能”)用此装置来验证氯、碘的非金属性强弱,若不能,需如何改进____________,若能,此问不用回答。
参考答案:(1)不合理;醋酸具有挥发性,C中生成的白色胶状沉淀可能是Na2SiO3与醋酸反应所得在;A与C之间增加盛有饱和NaHCO3溶液的洗气瓶(其他合理答案也可)
(2)取C中反应后的上层溶液少许于试管中,加入氯化钙溶液,若有白色沉淀生成,则甲同学观点正确;若无明显现象,则乙同学观点正确
(3)CO2溶于水,与Ca(ClO)2反应生成难溶于水的CaCO3,减小了溶液中的离子浓度,使反应能够发生;
密封、干燥
(4)不能;增加尾气的处理装置,因为Cl2扩散到空气中会导致大气污染
本题解析:
本题难度:一般
2、实验题 新切开的苹果在空气中放置一段时间表面会变黄,最终变成褐色,这种现象在食品科学上通常称为“褐变”。?关于苹果褐变的原因有以下两种说法:
A.苹果中的Fe2+被空气中的氧气氧化成了Fe3+? ?
B.苹果中的酚类物质被空气中的氧气氧化了? ?
究竟哪种说法正确,某合作小组同学通过实验进行了探究。
材料:苹果、浓度均为0.1mol·L-1的盐酸、氯化钠溶液、碳酸氢钠溶液、亚硫酸钠溶液、硫氰化钾溶液、开水
(1)探究1: 
(2)探究2:查阅文献: ?
Ⅰ.苹果中含有多酚和多酚氧化酶,苹果褐变是氧气、酚类、酚氧化酶共同作用生成了醌类物质的缘故。苹果中多酚氧化酶的活性温度为35℃左右、活性pH约为5.5。 ?
Ⅱ.酚类物质遇FeCl3溶液常发生显色反应而呈现一定颜色,如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色。 ?
该小组将刚削皮的苹果切成七块,进行如下实验验证。请填写下表中相应的结论 
(3)问题与讨论:
①0.1mol·L-1的碳酸氢钠溶液和亚硫酸钠溶液的pH相近,亚硫酸钠溶液却能阻止苹果褐变,可能的原因是_____________,反应的离子方程式为:__________________________?。
②褐变会影响苹果的品质和口感,试举出家中防止削皮苹果褐变的两种措施:_________________、________________。
参考答案:(1)硫氰化钾或KSCN;无红色出现
(2)氧气;酚氧化酶的活性(合理答案均可)?
(3)①亚硫酸钠的还原性比酚强,消耗了氧气,保护了酚;2SO32-+O2==2SO42-
②放入冰箱冷藏;用保鲜膜包裹(或泡在盐水里等合理答案均可)
本题解析:
本题难度:一般
3、简答题 亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解.以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
(1)提高“反应1”反应速率的措施有______、______等.
(2)“反应2”的氧化剂是______,该反应的化学方程式为:______.
(3)采取“减压蒸发”而不用“常压蒸发”,原因是______.
(4)从“母液”中可回收的主要物质是______.
(5)“冷却结晶”后经______(填操作名称)即可获得粗产品.
参考答案:(1)对伊气体和液体的反应,为提高反应速率,可适当升高反应温度;增大吸收液浓度,增大SO2与吸收液的接触面积,
故答案为:适当升高反应温度;增大吸收液浓度等;
(2)具有氧化性,根据生成NaClO2目标物的特点可知,反应的方程式为H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2,反应中Cl元素的化合价降低,则ClO2为氧化剂,
故答案为:ClO2;H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2;
(3)减压蒸发在较低温度下可进行,防止常压蒸发温度过高,亚硫酸钠容易分解,
故答案为:常压蒸发温度过高,亚硫酸钠容易分解;
(4)氯酸钠与二氧化硫在酸性条件下发生氧化还原反应生成ClO2和Na2SO4,则母液中应含有Na2SO4,
故答案为:Na2SO4;
(5)冷却结晶后要分离出固体,应用过滤的方法,故答案为:过滤.
本题解析:
本题难度:一般
4、实验题 苯和溴的取代反应的实验装置如图所示,其中A为带支管口的试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉。
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):_______________________。
(2)试管C中苯的作用是__________。反应开始后,观察D和E两试管,看到的现象为________。
(3)反应2~3 min后,在B中可观察到的现象是_________。利用这种方法得到的粗溴苯中还含有的杂质主要是?,需进一步提纯,下列操作中必须的是?(填正确答案前的字母)
A.蒸馏
B.重结晶
C.过滤
D.萃取
(4)该实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是_____________。
参考答案:(12分) (1)
(2)除去HBr气体中混有的溴蒸气? D试管中石蕊试液慢慢变红,并在导管口有白雾产生,然后E试管中出现浅黄色沉淀? (3)在溶液底部有无色油状液体?苯? A
(4)充分吸收有毒气体,防止污染环境
本题解析:(1)在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成:C6H6+Br2 ?C6H5Br+HBr,
?C6H5Br+HBr,
故答案为:C6H6+Br2 C6H5Br+HBr;
C6H5Br+HBr;
(2)苯和液溴反应生成溴苯和溴化氢,溴化氢的溶液呈酸性,与紫色的石蕊试剂显红色,溴化氢与硝酸银反应生成浅黄色的溴化银和硝酸,且溴化银不溶于硝酸,
故答案为:除去HBr气体中混有的溴蒸气? D试管中石蕊试液慢慢变红,并在导管口有白雾产生,然后E试管中出现浅黄色沉淀;
(3)溴苯是有机物,氢氧化钠溶液是无机物,所以溴苯和氢氧化钠溶液不互溶,且溴苯的密度大于水的密度,所以在B中的氢氧化钠溶液里可观察到的现象是底层出现油状液体。
故答案为:在溶液底部有无色油状液体?苯? A。
(4)溴化氢溶于水能得到氢溴酸,溴和水反应也可得到氢溴酸,如果没有C装置,无法判断该反应中是否有溴化氢生成;苯溶解了溴,除去的溴的干扰,所以能判断该反应有溴化氢生成,故答案为:充分吸收有毒气体,防止污染环境。
点评:本题考查了苯的取代反应实验,考查的知识点有反应方程式的书写、产物的判断、蒸汽的成分及性质,综合性较强,难度较大,注意苯能和液溴发生取代反应,和溴水不反应。
本题难度:一般
5、填空题 硫酸亚铁是一种可用于治疗缺铁性贫血的药剂,硫酸亚铁药片外表包有一层特制的糖衣,以保护硫酸亚铁不与空气中的氧气反应而变质(变质后的硫酸亚铁无治疗贫血的药效),试设计一个实验方案,检验某硫酸亚铁药片是否已变质
(1)实验步骤:①刮去药片上的糖衣,把药片碾碎,放入烧杯中,溶解;
②过滤后向滤液中加入?;(填试剂名称或化学式)
(2)现象及结论:?;
(3)医学上常将维生素C与硫酸亚铁药剂配合服用,以防止硫酸亚铁变质,这是利用了维生素C的?性。(填“氧化”、“还原”、“酸”、“碱”等)
参考答案:(1)KSCN溶液(2)如果溶液呈现血红色,则该硫酸亚铁药片已变质,反之,则无(其他合理答案亦可)(3)还原
本题解析:略
本题难度:简单