时间:2017-09-25 17:23:16
1、选择题 有一真空储气瓶净重500g,在相同条件下,装满CO2?后重511g,装满另一种X气体后重507g,则X可能是下列哪种气体
A.O2
B.N2
C.Cl2
D.CH4
2、选择题 为了除去镀在铝表面的铜镀层,可选用的试剂为
A.浓硫酸
B.稀HNO3
C.NaOH溶液
D.浓HNO3
3、选择题 下列对于“摩尔”的理解正确的是
A.摩尔是国际单位制的七个物理量之一
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔是表示物质质量的单位
D.1mol氧含6.02×1023个O2
4、选择题 下列实验装置进行的相应实验,能达到实验目的的是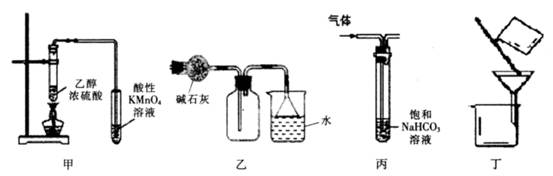
A.装置甲可用于检验有乙烯生成
B.装置乙可用于收集和吸收氨气
C.装置丙可用于除去CO2中混有的HCl气体
D.装置丁可用于除去溴苯中的溴
5、选择题 下列各组液体混合物,用分液漏斗不能分开的是
A.水与煤油
B.氯乙烷和水
C.甲苯和水
D.苯和溴苯