时间:2017-09-25 17:22:55
1、选择题 在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图)。该晶体可能为 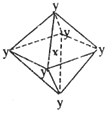
[? ]
A.NaCl?
B.CsCl
C.CO2?
D.SiO2
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列各物质中存在极性键和非极性键,且属于离子晶体的是
A.醋酸钠
B.过氧化钠
C.氯化铵
D.过氧化氢
参考答案:A
本题解析:活泼金属阳离子与阴离子、铵盐一般为离子晶体,排除D;ABC三物质均含有离子键;
CH3COONa还含有C—C非极性键及C—H极性键等键,符合题意
过氧化钠还含有O—O非极性键,氯化铵还含有N—H极性键
本题难度:一般
3、填空题 决定物质性质的重要因素是物质结构.请回答下列问题.
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 A 578 1817 2745 11578 B 738 1451 7733 10540 |
| 共价键 | C-C | C-N | C-S 键能/kJ?mol-1 347 305 259 |
| 离子晶体 | NaCl | KCl | CaO 晶格能/kJ?mol-1 786 715 3401 |
参考答案:(1)从表中原子的第一至第四电离能可以看出,A的第一、第二、第三电离能都较小,可失去3个电子,最高化合价为+3价,应为Al元素,可失去2个电子,即最外层应有2个电子,应为Mg元素;
周期表中,同周期元素从左到右电负性逐渐增强,则A、B的电负性从大到小的顺序为Al、Mg,因为元素Mg价电子排布式为3s2完全充满状态,比Al稳定,所以Mg的第一电离能大于Al.
故答案为:+3;>.
(2)波长为300nm的紫外光的光子所具有的能量约为399kJ/mol,比蛋白质分子中C-C、C-N和C-S的键能都大,所以波长为300nm的紫外光的光子能破坏蛋白质分子中的化学键,从而破坏蛋白质分子.
故答案为:紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.
(3)离子晶体中晶格能越大,形成的离子晶体越稳定,熔点越高硬度越大,晶格能与离子的半径、电荷有关,电荷越多、离子半径越小,晶格能越大,TiN中阴阳离子所带电荷为3,大于其它离子所带电荷,MgO、CaO中所带电荷相同,但镁离子半径小于钙离子半径,氯化钾中阴阳离子所带电荷为1,且钾离子半径>钙离子半径,氯离子半径大于氧离子半径,所以KCl、MgO、CaO、TiN4种离子晶体熔点从高到低的顺序是TiN>MgO>CaO>KCl;?
MgO的晶体结构与NaCl的晶体结构相似,所以一个Mg2+周围和它最邻近且等距离的Mg2+个数为12.
故答案为:TiN>MgO>CaO>KCl;? 12.
(4)V2O5中钒离子的核外电子排布式为:1s22s22p63s23p6;CrO2中铬离子的核外电子排布式为:
1s22s22p63s23p63d2,所以CrO2中的未成对电子数大于V2O5中未成对电子数,故选CrO2.
故答案为:CrO2.
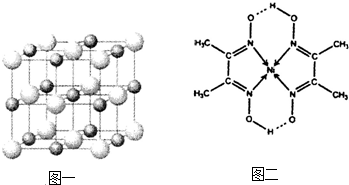
(5)该配合物中存在的化学键有:非金属元素之间的共价键,镍元素与氮元素之间的配位键,氧原子和氢原子之间的氢键,故选AC.
故答案为AC.
本题解析:
本题难度:一般
4、选择题 区别晶体与非晶体最可靠的方法是
[? ]
A.熔点
B.X-射线衍射实验
C.颜色
D.透明度
参考答案:B
本题解析:
本题难度:简单
5、选择题 超细铜粉主要应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下: 
试回答下列问题:下列关于[Cu(NH3)4]SO4的说法中,不正确的是
[? ]
A.与SO32-离子互为等电子体的分子有PF3、NCl3、PCl3等
B.NH4CuSO3与硫酸微热反应的离子方程式为NH4CuSO3+4H+ 2NH4++Cu2++Cu+2SO2↑+2H2O
2NH4++Cu2++Cu+2SO2↑+2H2O
C.[Cu(NH3)4]SO4中所含的化学键只有极性键和配位键
D.[Cu(NH3)4]SO4的外界离子的空间构型为正四面体
参考答案:C
本题解析:
本题难度:一般