时间:2017-09-25 17:22:33
1、填空题 (10分)按要求填空:
(1)2.7 g H2O所含氢原子数与 L(标准状况下)NH3所含氢原子数相等。
(2)以下物质:① NH3 ② CaCO3 ③ 蔗糖 ④ 饱和食盐水 ⑤ H2SO4 ⑥Cu
属于电解质的有 (填序号)。
(3)用单线桥标出下列反应中电子转移的方向和数目:
MnO2+4HCl(浓)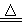 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
① 该反应中的氧化剂是 。
②如反应中转移了0.2 mol电子,则产生的Cl2在标准状况下体积为 L。
参考答案:(1) 2.24 (2) ②、⑤
(3)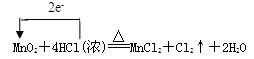 ① MnO2 ② 2.24
① MnO2 ② 2.24
本题解析:(1)2.7 g H2O的物质的量为:n="m/M=2.7g÷18g/mol=0.15mol," 氢原的物质的量为:0.15mol×2=0.3mol,则NH3的物质的量为0.1mol,V=n×22.4L/mol=0.1mol×22.4L/mol=2.24L (2)电解质主要包括酸、碱、盐和水,①NH3是非电解质 ②CaCO3 属于盐类,是电解质 ③ 蔗糖是非电解质 ④ 饱和食盐水是混合物,既不是电解质也不是非电解质 ⑤H2SO4属于酸,是电解质,⑥Cu属于单质既不是电解质也不是非电解质。(3)单线桥表电子转移方向和数目时箭头是从还原剂指向氧化剂,在线桥注明电子的转移个数,根据化合价的改变:Mn从+4价降低变为+2价,Cl从-1价升高到0价,所以氧化剂是MnO2,还原剂是HCl,转移电子数为2e-,则用单线桥标出下列反应中电子转移的方向和数目为: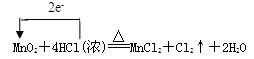 ,如反应中转移了0.2 mol电子则生成Cl2为0.1mol,,V="n×22.4L/mol=0.1mol×22.4L/mol" =2.24L
,如反应中转移了0.2 mol电子则生成Cl2为0.1mol,,V="n×22.4L/mol=0.1mol×22.4L/mol" =2.24L
考点:电解质的判断,有关物质的量的计算、氧化还原反应的基本知识。
本题难度:一般
2、选择题 下列物质中,属于电解质的是
A.蔗糖
B.盐酸
C.氯化钠
D.二氧化碳
参考答案:C
本题解析:水溶液或熔融状态下能导电的化合物为电解质,蔗糖为非电解质,A错误;盐酸是混合物,既不是电解质也不是非电解质,B错误;氯化钠在水溶液或熔融状态下导电,故为电解质,C正确;二氧化碳的水溶液导电,但是生成的碳酸导电,故二氧化碳为非电解质,D错误,答案选C.
考点:电解质和非电解质
本题难度:一般
3、选择题 若A + 酸 = 盐 + 水,则A不可能属于
A.氧化物
B.单质
C.碱
D.电解质
参考答案:B
本题解析:A.酸和碱反应、酸和金属氧化物反应、碱和非金属氧化物反应都能生成盐和水,A、C正确;碱属于电解质,D正确,B.活泼金属单质与酸反应生成,盐和氢气,金属与浓硫酸反应生成盐,二氧化硫和水,金属与硝酸反应生成盐、氮的氧化物和水,因此金属与酸反应必有电子转移,除生成盐和水以外,还有气体,选B。
考点:考查化学反应。
本题难度:一般
4、填空题 (6分)现有以下物质:①NaCl晶体②液态(纯)H2SO4 ③液态的(纯)醋酸 ④汞(金属)⑤纯蔗糖(C12H22O11) ⑥酒精(C2H5OH) ⑦熔化的KNO3,请回答下列问题(用序号):
(1)以上物质中能导电的是 ;
(2)以上物质中属于电解质的是 ;
(3)以上物质中属于非电解质的是 。
参考答案:(1)④⑦ (2) ①②③⑦ (3)⑤⑥
本题解析:(1)④汞中有自由电子,所以能导电;⑦熔化的KNO3中有自由移动的离子,所以能导电;①NaCl晶体、②液态(纯)H2SO4、③液态的(纯)醋酸、⑤纯蔗糖(C12H22O11)、⑥酒精(C2H5OH)没有自由移动的离子或自由电子,所以不能导电,故答案为:④⑧;(2)在水溶液里或熔融状态下能导电的化合物是电解质,所以①NaCl晶体、②液态(纯)H2SO4 ③液态的(纯)醋酸、⑦熔化的KNO3是电解质;故答案为:①②③⑦;(3)非电解质是在水溶液里或熔融状态下都不能导电的化合物,所以⑤纯蔗糖(C12H22O11)、⑥酒精(C2H5OH)是非电解质;故答案为:⑤⑥。
考点:电解质与非电解质;电解质溶液的导电性
本题难度:一般
5、选择题 化学用语是学习化学的重要工具,下列化学用语中正确的是
A.Na2S的水解:S2-+ 2H2O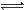 H2S + 2OH-
H2S + 2OH-
B.NaHCO3的电离:NaHCO3 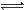 Na + + H+ + CO32-
Na + + H+ + CO32-
C.HSO3-的电离:HSO3- 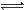 H+ + SO32-
H+ + SO32-
D.钢铁的电化学腐蚀的负极反应式:Fe-3e-Fe3+
参考答案:C
本题解析:S2-的水解要分两步进行,A错;HCO3-是一个整体不能拆开,NaHCO3 是强电解质,完全电离,B错;HSO3-在溶液中主要以电离为主,C正确;钢铁的电化学腐蚀的负极反应式应该是:Fe-2e- Fe2+,D错。
考点:电离、水解的离子方程式、金属腐蚀的电极反应。
本题难度:一般