时间:2017-09-25 17:13:32
1、选择题 下图装置中,U型管内为红墨水,a,b试管内分别盛有食盐水和稀醋酸溶液,各加入生铁块,放置一段时间后,下列有关描述正确的是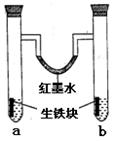
A.红墨水柱两边的液面变化是左高右低
B.b试管中溶液pH值减小
C.两试管中相同的电极反应式是: Fe-3e-=Fe3+
D.a试管中阳极反应式为:O2+2H2O-4e-=4OH-
参考答案:A
本题解析:略
本题难度:简单
2、填空题 下图为氢氧燃料电池原理示意图,请根据提示写出正负极的电极反应式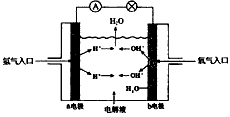
(1) 以硫酸为电解液:负极:________________正极:________________
(2) 以氢氧化钾为电解液:负极:____________________正极:___________________
参考答案:(1)2H2-4e-==4H+;O2+4H++4e-==2H2O
(2)2H2-4e-+4OH-=4H2O;O2+2H2O+4e-==4OH-
本题解析:
本题难度:一般
3、选择题 将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )
A.镁比铝活泼,镁失去电子被氧化成Mg2+
B.铝是电池负极,开始工作时溶液中会立即有白色沉淀生成
C.该装置的内、外电路中,均是电子的定向移动形成电流
D.该装置开始工作时,铝片表面的氧化膜可不必处理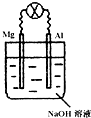
参考答案:A、在NaOH溶液中,铝能与NaOH溶液发生氧化还原反应,在该反应中,铝失电子作原电池的负极,而属镁和氢氧化钠溶液不能发生氧化还原反应,故A错误;
B、在NaOH溶液中,铝能与NaOH溶液发生氧化还原反应,在该反应中,铝失电子作原电池的负极,由于电池开始工作时,生成的铝离子的量较少,NaOH过量,此时不会有Al(OH)3白色沉淀生成,故B错误;
C、该装置外电路,是由电子的定向移动形成电流,而内电路,则是由溶液中自由移动的离子的定向移动形成电流,故C错误;
D、由于铝片表面的氧化膜也能与NaOH溶液反应,故其不必处理,故D正确.
故选D.
本题解析:
本题难度:简单
4、填空题 雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为_____________
(2)上述反应中的氧化剂是________,反应产生的气体可用_________吸收。
(3)As2S3和HNO3有如下反应:As2S3+?10H++?10NO3-=2H3AsO4+?3S+10NO2↑+?2H2O 若生成2mol?H3AsO4,则反应中转移电子的物质的量为_______。若将该反应设计成一原电池,则NO2应该在______(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L?O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量________(选填编号)。
a.小于0.5?mol?b.等于0.5?mol? c.大于0.5mol?d.无法确定
参考答案:(1)1 :1
(2)As2S3;氢氧化钠溶液或硫酸铜溶液
(3)10mol;正极
(4)a
本题解析:
本题难度:一般
5、选择题 判断在下列装置中电流表能发生偏转的是( )
参考答案:C
本题解析:略
本题难度:简单