时间:2017-09-25 17:13:32
1、填空题 (7分)选择适宜的材料和试剂设计一个原电池,完成下列反应:
Zn + CuSO4 = ZnSO4 + Cu(1)注明电极材料和电解质溶液各是什么?
(2)写出电极反应式:
正极:?;
负极:??。
参考答案:(1)①Zn?②Cu等?③CuSO4
(2)负极:Zn –2e- = Zn2+?正极:Cu2+ + 2e- = Cu
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。因此根据总反应式可知,锌是还原剂,失去电子。硫酸铜是氧化剂,铜离子得到电子。是由负极越大是锌,正极可以是石墨等比锌不活泼的电极,电解质溶液是硫酸铜。其中电极反应式分别是负极:Zn –2e- = Zn2+、正极:Cu2+ + 2e- = Cu。
本题难度:一般
2、填空题 (9分) 右图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为:
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置 (填“能”或“不能”)形成原电池,若不能,请说明理由,若能,请指出正、负极
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用酸性溶液为电解液;则氢气应通入 极(填a或b,下同),电子从 极流出。a极发生电极反应式为:_________________________
参考答案:(1)2H++2e=H2(2分)能,正,镁;负,铝各1分
(3)B,B 各1分 4H+ + O2+ 4e-= 2H2O 2分
本题解析:略
本题难度:一般
3、选择题 根据图,可判断出下列离子方程式中错误的是( )
A.2Ag(s)+Cd2+(aq)═2Ag+(?aq)+Cd(s)
B.Cd(s)+Co2+(aq)═Cd2+(?aq)+Co(s)
C.2Ag+(aq)+Cd(s)═2Ag(s?)+Cd2+(aq)
D.2Ag+(aq)+Co(s)═2Ag(s?)+Co2+(aq)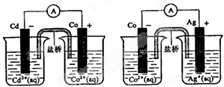
参考答案:A、分析图示反应原理可知金属Cd活泼性强于Ag,所以Cd可以置换Ag,故A错误;
B、根据原电池的构成条件可以知道右图所示装置是原电池的构成装置,装置1中Cd为负极,发生Cd置换Co的反应,说明Cd的活泼性强于Co,故B正确;
C、分析图示反应原理可知金属Cd活泼性强于Ag,所以Cd可以置换Ag,故C正确.
D、装置2中Co为负极,发生Co置换Ag的反应,说明Co的活泼性强于Ag,发生Co置换Ag的反应,故D正确,
故选A.
本题解析:
本题难度:一般
4、填空题 研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示) 。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:
负极 ,正极 。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。(填序号)
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3、NO的体积比保持不变
D.每消耗 1 mol SO2,同时生成1 mol NO
当测得上述平衡体系中NO2与SO2体积比为1:6时,则该反应平衡常数K值为 ;
(4)工业常用Na2CO3饱和溶液回收NO、NO2气体:
NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2
若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为 。
参考答案:(1)CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(2)负极:2CH3OH-12e-+2H2O 2CO2+12H+ 正极:3O2+12e-+12H+ 6H2O
(3) B 2.67(或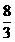 ) (4)1∶7
) (4)1∶7
本题解析:(1)因为化学反应的过程就是原子重新组合的过程,由于“绿色化学”就是反应物的原子完全转化为目标生成物,所以使用CO、H2来制取CH3OH 。反应的方程式为:CO(g)+来源:91考试网 91Exam.org2H2(g)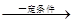 CH3OH(g)。(2)左边通入甲醇的电极为负极,电极反应为:2CH3OH-12e-+2H2O=2CO2+12H+;右边通入O2的电极为正极,由于是酸性介质,发生的电极反应为:3O2+12e-+12H+=6H2O。(3)NO2和SO2反应生成SO3(g)和NO的方程式为:NO2+SO2
CH3OH(g)。(2)左边通入甲醇的电极为负极,电极反应为:2CH3OH-12e-+2H2O=2CO2+12H+;右边通入O2的电极为正极,由于是酸性介质,发生的电极反应为:3O2+12e-+12H+=6H2O。(3)NO2和SO2反应生成SO3(g)和NO的方程式为:NO2+SO2 SO3(g)+NO.A.该反应是反应前后气体体积相等的可逆反应,所以无论反应是否达到平衡,反应的压强都不会发生变化。B.由于容器的容积不变,若反应达到平衡,任何物质的物质的量不变,NO2是有色的物质,其浓度不变,所以混合气体颜色保持不变。因此该反应达到平衡。正确。C.发生反应NO2+SO2
SO3(g)+NO.A.该反应是反应前后气体体积相等的可逆反应,所以无论反应是否达到平衡,反应的压强都不会发生变化。B.由于容器的容积不变,若反应达到平衡,任何物质的物质的量不变,NO2是有色的物质,其浓度不变,所以混合气体颜色保持不变。因此该反应达到平衡。正确。C.发生反应NO2+SO2 SO3(g)+NO ,每产生SO31mol,必然同时产生NO1mol。因此无论反应是否达到平衡,SO3、NO的体积比始终保持不变。故不能作为反应达到平衡的标志。错误。D.SO2是反应物,NO为生成物,方程式中二者的物质的量的比为1:1,所以每消耗 1 mol SO2,同时生成1 mol NO ,与反应是否达到平衡无关,因此不能作为反应达到平衡的标志。错误。假设反应开始时,n(NO2)="amol;" n(SO2)=2amol.。在反应过程中?n(NO2)="xmol" ,则?n(SO2)=xmol,则达到平衡是反应NO2+SO2
SO3(g)+NO ,每产生SO31mol,必然同时产生NO1mol。因此无论反应是否达到平衡,SO3、NO的体积比始终保持不变。故不能作为反应达到平衡的标志。错误。D.SO2是反应物,NO为生成物,方程式中二者的物质的量的比为1:1,所以每消耗 1 mol SO2,同时生成1 mol NO ,与反应是否达到平衡无关,因此不能作为反应达到平衡的标志。错误。假设反应开始时,n(NO2)="amol;" n(SO2)=2amol.。在反应过程中?n(NO2)="xmol" ,则?n(SO2)=xmol,则达到平衡是反应NO2+SO2 SO3(g)+NO平衡体系中n(NO2)=(a-x)mol;n(SO2)=(2a-x)mol;n(SO3)=xmol;n(NO)=xmol。由于平衡时NO2与SO2体积比为1:6,所以(a-x):(2a-x)=1:6.解得
SO3(g)+NO平衡体系中n(NO2)=(a-x)mol;n(SO2)=(2a-x)mol;n(SO3)=xmol;n(NO)=xmol。由于平衡时NO2与SO2体积比为1:6,所以(a-x):(2a-x)=1:6.解得 .所以在该温度下该反应平衡常数
.所以在该温度下该反应平衡常数 。(4)由方程式可以看出:每产生1mol的CO2,消耗混合气体2mol。现在产生2.24L标志状况下的CO2,即产生0.1 mol CO2,所以消耗气体0.1mol..则混合气体的摩尔质量为44g/mol.假设NO为xmol, NO2为(1-x)mol.30x+46(1-x)=44.则x:(1-x)=1:7.
。(4)由方程式可以看出:每产生1mol的CO2,消耗混合气体2mol。现在产生2.24L标志状况下的CO2,即产生0.1 mol CO2,所以消耗气体0.1mol..则混合气体的摩尔质量为44g/mol.假设NO为xmol, NO2为(1-x)mol.30x+46(1-x)=44.则x:(1-x)=1:7.
考点:考查化学反应的经济性、原电池中电极反应式的书写、化学平衡状态的判断、平衡常数的计算、气体混合物中物质的混合比例的计算的知识。
本题难度:困难
5、填空题 某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响, 烧杯中都盛有稀H2SO4。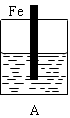

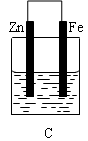
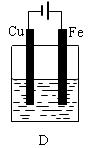
试回答:
(1)B装置中Cu电极上的电极反应式为?,D装置中Fe电极上的电极反应式为?。
(2)D装置中的实验现象有?,若用电流表测量反应时通过导线的电子流量为0.2mol,则Fe电极的质量变化为?。
(3)B、C两个装置中Fe片被腐蚀的速率更快的是?(填B或C)。
参考答案:(1) 2H++2e-=H2 ↑,Fe-2e-=Fe2+。
(2)Cu电极上有气泡,Fe电极逐渐溶解,溶液逐渐变为浅绿色,减小5.6g。 (3)B
本题解析:(1)在B装置中由于活动性Fe>Cu,所以Cu电极为原电池的正极,在正极上的电极反应式为2H++2e-=H2↑,D装置为电解池。由于在D装置中Fe电极与直流电源的正极相连接,所以为阳极。在Fe电极上的发生氧化反应,电极反应式为Fe-2e-=Fe2+。(2)在D装置中可看到的实验现象有Fe电极逐渐溶解消耗,在Cu电极上不断有气泡产生。同时溶液逐渐由无色变为浅绿色。若用电流表测量反应时通过导线的电子流量为0.2mol,因为Fe是+2价的金属,则Fe电极消耗的物质的量为0.1mol,由于Fed的摩尔质量为56g/mol,所以其质量变化为减少5.6g,(3)由于金属活动性Zn>Fe>Cu.所以在B装置中Fe为原电池的负极,被氧化而腐蚀;在C装置中Fe片作原电池的正极,首先被腐蚀的是活动性强的Zn,Fe被保护起来。因此在B、C两个装置中被腐蚀的速率更快的是B。
本题难度:一般