时间:2017-09-25 17:13:11
1、推断题 【三选一—选修物质结构与性质】
A、B、C、D为原子序数依次增大的短周期元素。A原子核外电子有5种运动状态,B是地壳中含量最多的元素,A、C、D未 ?成对电子数之比为1:3:1。E有“生物金属”之称,E4+和氩原子的核外电子排布相同,请回答下列问题(各元素用相应的元素符号表示): ?
(1)五种元素所形成的XY3型化合物的化学式可能为___,其中心原子杂化方式依次为____。
(2)在元素周期表中与C同周期但不同区的金属元素有?___种。 ?
(3)B与D形成的以D为中心的三原子分子中,B的质量分数约为47%,则分子的空间构型为____。 ?
(4)E的一种氧化物M的晶胞结构如图所示,则M的化学式为____,该晶体中氧原子的配位数为____。? 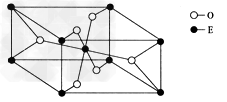
(5)下列晶体的堆积方式与E的单质晶体的堆积方式相同的有____。 ①Po?②Zn?③Ag?④K?
(6)B可形成两种同素异形体,其中在水中溶解度更大的是___(填化学式),原因是____。
参考答案:(1)BCl3.PCl3?;sp2.sp3
(2)2
(3)V形
(4)TiO2?;3
(5)②
(6)O3;O3是极性分子,O2是非极性分子,根据相似相溶原理,O3更易溶于极性溶剂水中
本题解析:
本题难度:一般
2、推断题 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+原子核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
(1)E元素基态原子的核外电子排布式为__________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_________(填元素符号),其原因是___________________。
(3)D元素与氟元素相比,电负性。D______(填“>”“=” 或“<”)F,下列表述中能证明这一事实的是_________(填选项序号)。
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为_________;1 mol B2A4分子中含_______mol σ键。
参考答案:(1)1s22s22p63s23p63d104s1
(2)C<O<N;同一周期,随着原子序数的增加,元素的第一电离能呈现逐渐增大的趋势,但氮元素的最外层电子达到半充满的稳定构型,其第一电离能大于氧元素
(3)<;BC
(4)sp2杂化;5
本题解析:
本题难度:一般
3、简答题 下列说法正确的是( )
A.门捷列夫编制的第一张元素周期表是按相对原子质量由小到大依次来源:91考试网 91ExAm.org排列的
B.第二周期元素的最高化合价为+1→+7
C.同族元素的最外层电子数一定相同
D.同周期元素的电子层数不一定相同
参考答案:A.1869年门捷列夫编制的第一张元素周期表,是按相对原子质量由小到大依次排列的,故A正确;
B.第二周期元素中O、F没有正价,则元素的最高化合价不会由+1→+7,故B错误;
C.同主族元素的最外层电子数一定相同,零族中He的最外层电子数为2,其余为8,则同族元素的最外层电子数不一定相同,故C错误;
D.同周期元素的电子层数相同,电子层数等于周期数,则同周期元素的电子层数一定相同,故D错误;
故选A.
本题解析:
本题难度:一般
4、选择题 以下有关原子半径的叙述正确的是( )
A.原子半径的大小取决于原子核外电子层数
B.原子半径的大小取决于核电荷数
C.同周期主族元素,原子半径随原子序数增大而增大
D.同主族元素,原子半径随原子序数减小而减小
参考答案:A.原子半径大小由核电荷数、核外电子数、电子层数决定,故A错误;
B.原子半径大小由核电荷数、核外电子数、电子层数决定,故B错误;
C.同周期元素,原子电子层数相同,其原子半径随核电荷数的增加而减小,故C错误;
D.同主族元素,电子层越多原子半径越大,即原子半径随原子序数减小而减小,故D正确,
故选D.
本题解析:
本题难度:一般
5、选择题 下列关于元素周期表的叙述,不正确的是
[? ]
A.共有7个周期,16个族
B.形成化合物种类最多的元素在第二周期
C.第ⅡA族的右边是第ⅢB族,第ⅢA族的左边是第ⅡB族
D.某主族元素最高价氧化物对应的水化物的化学式为HnROm,其气态氢化物的化学式一定为H2m-nR或
RH2m-n
参考答案:D
本题解析:
本题难度:简单