时间:2017-09-25 17:12:28
1、填空题 用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定量的HA配制0.1mol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是__________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH________(选填<、>、=)1。
乙方案中,说明HA是弱电解质的现象是_________(多选不给分)。
a. 装盐酸溶液的试管放出H2的速率快。
b. 装HA溶液的试管放出H2的速率快。
c. 两个试管中产生H2的速率一样快。
(3)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
____________________________________________________________。
参考答案:(4分,每空1分)(1)100mL容量瓶?(2)> ?b?
(3)配制NaA溶液,测其pH>7即证明HA是弱电解质(其它答案合理均可)
本题解析:(1)配制一定物质的量浓度溶液需要的仪器是容量瓶,所以在两个方案的第①步中,都要用到的定量仪器是100mL容量瓶。
(2)100 mL 0.1 mol/LHA溶液,若HA为弱酸,c(H+)<0.1 mol/L,pH>1;100 mL pH=1的HA和盐酸比较,c(HCl)="0.1" mol/L,若HA为弱酸,则c(HA)>0.1 mol/L。分别取10 mL pH=1的盐酸和HA溶液,同时加水稀释到100 mL,稀释后,盐酸溶液中c(H+)="0.01" mol/L,HA溶液中c(H+) >0.01 mol/L,因为加水稀释时,HA的电离度增大,即有一部分HA分子会电离出H+,因此在稀释后100 mL盐酸和100 mL HA溶液中分别加入纯度相同的锌粒时,HA溶液产生氢气速率快。
(3)中学化学中常用的方法还有一些,比如①测定NaA溶液的pH;②测定相同条件下HA和一元强酸溶液,测其导电能力;③取相同条件下pH相同的HA与一元强酸溶液导电能力;④取相同条件下pH相同的HA与一元强酸溶液,分别稀释到相同的pH,测加水量多少;⑤取相同条件下,pH相同的HA与一元强酸溶液分别加相应的钠盐固体,测pH变化值大小等。当然以上方法中①为操作最简单、最方便的方法。
点评:该题是高考中的常见题型,属于中等难度的试题。该题是运用知识解决实际问题的一道很好的题目。它不但考查了一些有关一元强酸和一元弱酸的重要知识,同时还考查了一些综合实验能力。
本题难度:一般
2、选择题 现有物质的量浓度为0.1 mol/L的盐酸和0.1 mol/L的氨水,下列说法中正确的是(?)
A.用湿润的pH试纸测定两种溶液的pH时,氨水的误差更大
B.若混合后溶液恰好呈中性时:c(Cl-)= c(NH4+)+ c(NH3·H2O)
C.两溶液等体积混合时,充分反应后:c(Cl-)> c(NH4+)> c(OH-)> c(H+)
D.恰好反应呈中性时,所需氨水的体积大于盐酸的体积
参考答案:D
本题解析:A选项,用润湿的PH试纸测定两种溶液时,弱电解质PH变化更小。故A错误。B选项,若混合后溶液恰好呈中性时:c(Cl-)= c(NH4+),故B错误。C选项,两溶液等体积混合时,充分反应后:c(Cl-)> c(NH4+)>c(H+)>c(OH-),故C选项错误。D选项,正确。
本题难度:一般
3、填空题 现有浓度均为0.1 mol·L-1的下列溶液:
①硫酸;②醋酸溶液;③氢氧化钠溶液;④氯化铵溶液;⑤醋酸铵溶液;⑥硫酸铵溶液;⑦硫酸氢铵溶液;⑧氨水。请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________。
(2)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)________。
(3)将③和④等体积混合后,混合液中各离子浓度关系正确的是________。
A.c(Na+)=c(Cl-)>c(OH-)>c(NH4+)
B.c(Na+)=0.1 mol·L-1
C.c(Na+)+c(NH4+)=c(Cl-)+c(OH-)
D.c(H+)>c(OH-)
参考答案:(1)④②③① (2)⑦④⑤⑧ (3)A
本题解析:(1)①、②、③抑制水的电离,①中c(H+)=0.2 mol·L-1,②中c(H+)<0.1 mol·L-1,③中c(OH-)=0.1 mol·L-1,④促进水的电离,故四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①。(2)NH4HSO4溶液中,H+抑制NH4+水解,CH3COONH4溶液中,CH3COO-促进NH4+的水解,NH3·H2O是弱电解质,电离产生极少的NH4+,故四种溶液中NH4+浓度由大到小的顺序为⑦④⑤⑧。(3)NaOH溶液和NH4Cl溶液等浓度等体积混合:NaOH+NH4Cl=NaCl+NH3·H2O,c(Na+)=c(Cl-)=0.05 mol·L-1,c(OH-)=c(NH4+)+c(H+),A正确,B错误。根据电荷守恒,C错误。溶液显碱性c(OH-)>c(H+),D错误。
本题难度:一般
4、填空题 (6分)(1)体积相同,浓度均为0.2 mol/L的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为 。
(2)体积相同,浓度均为0.2mo l/L的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为 。
l/L的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为 。
(3)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为 。
参考答案:(6分)(1) m<n (2) m>n ( 3) m>n
3) m>n
本题解析:略
本题难度:一般
5、填空题 盐酸和醋酸是生产、生活和化学实验中常用的酸。请回答:
(1)人的胃液中含有盐酸,经测定某人胃液的pH=2,则其中的c(H+)=______mol/L。
(2)食醋常用于食品调味,其主要成分为醋酸。醋酸的电离方程式为:____________。
(3)室温下,pH=3的盐酸和醋酸溶液,下列各项中相等的是_______(填序号)。
① 溶液中c(H+) ② 酸的物质的量浓度 ③ 完全中和时,消耗NaOH的质量
(4)实验室配制氯化铁溶液时,加入少量盐酸的作用是______________。
参考答案:(1)0.01
(2)CH3COOH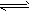 CH3COO-+H+
CH3COO-+H+
(3)①
(4)抑制Fe3+水解
本题解析:
本题难度:一般