时间:2017-09-25 17:11:25
1、选择题 控制合适的条件,将反应2Fe3++2I- 2Fe2+I2设计成如下图所示的原电池。下列说法不正确的是
2Fe2+I2设计成如下图所示的原电池。下列说法不正确的是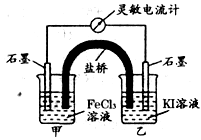
A.盐桥中的K+移向FeCl3溶液
B.反应开始时,乙中石墨电极上发生氧化反应
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
参考答案:D
本题解析:反应2Fe3++2I-?2Fe2++I2可知,铁元素的化合价降低,而碘元素的化合价升高,则图中甲烧杯中的石墨作正极,乙烧杯中的石墨作负极。A、根据电流方向,K+移向正极,即移向FeCl3溶液,正确;B、因乙中I-失去电子放电,元素的化合价升高,则发生氧化反应,正确;C、当电流计为零时,说明没有电子发生转移,则反应达到平衡,正确;D、当加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,而乙中石墨成为正极,正确。
本题难度:一般
2、填空题 (10分)下图是一个化学过程的示意图。
(1)图中乙池是 装置。
(2)c(Pt)电极的名称是 。
(3)写出通入CH3OH的电极的电极反应式是 。
(4)乙池中反应的离子方程式为 。
(5)当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下);此时丙池某电极析出1.6g某金属,则丙中的某盐溶液可能是 (填序号)
A.MgSO4
B.CuSO4
C.NaCL
D.AgNO3
参考答案:(10分)
(1)电解池 (1分)
(2) 阳极(1分)
(3)CH3OH+8OH--6 e- CO32-+6H2O(2分)
(4) 4Ag++2H2O 4Ag+O2↑+4H+(2分)
4Ag+O2↑+4H+(2分)
(5)280 (2分) B(2分)
本题解析:(1)由图可知甲池能自发发生氧化还原反应,是燃料电池,乙、丙都是电解池装置;
(2)甲池通入甲醇的一极是负极,氧气一极是正极,d与负极相连,所以d是阴极,则c是阳极;
(3)通入甲醇的一极是负极发生氧化反应,失去电子生成二氧化碳,二氧化碳与电解质溶液反应,最终生成碳酸根离子和水,电极反应式为CH3OH+8OH--6 e- CO32-+6H2O;
(4)乙是电解硝酸银溶液,A是阳极,B是阴极,所以阳极产生氧气,阴极产生Ag,离子方程式为4Ag++2H2O 4Ag+O2↑+4H+;
4Ag+O2↑+4H+;
(5)乙中B增加的质量是析出的Ag的质量,所以析出5.4gAg时转移电子的物质的量是5.4g/108g/mol=0.05mol,根据反应O2+4e-+2H2O=4OH-,可知甲池中理论消耗氧气得物质的量是0.05/4mol,标准状况下的体积是0.05/4mol×22.4L/mol=0.28L=280mL;丙池析出金属0.64g,丙池转移电子的物质的量也是0.05mol,若该金属是+1价,则该金属的相对原子质量是1.6/0.05=32,若该金属是+2价金属,则该金属的相对原子质量是1.6/0.05/2=64,所以答案选B。
考点:考查原电池、电解池的判断,电化学原理的应用
本题难度:一般
3、选择题 下图两个装置中,液体体积均为400 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得两池均有0.02 mol电子转移,若忽略溶液体积的变化,下列叙述正确的是 ?
?
A.②装置中硫酸根离子移向铜极
B.①中阴极质量增加,②中正极质量减小
C.产生气体的物质的量: ①=②
D.溶液的pH变化:①减小,②增大
参考答案:
本题解析:A项,②是原电池,锌作负极失电子生成Zn2+,锌极显正电性,带负电的硫酸根离子会移此极;B项,①中阴极反应式:Cu2++2e-=Cu,显然增加,②中正极反应式2H++2e-=H2↑,显然该极质量不变,故B项错误;C项,据①中电极反应式:阴极:Cu2++? 2e- ="?"
0.2mol? 0.4 mol
Cu,0.02mol小于0.4mol,即Cu2+没有放电完,
阳极:4OH-- 4e-= 2H2O + O2↑,?据②中电极反应式:正极:2H+?+ 2e-= H2↑,故两
0.02 mol? 0.005 mol? 0.02mol 0.01mol
装置中产生气体的物质的量不相等;D项,据①中总反应式:2Cu2++2H2O 2Cu+O2↑+4H+,可知溶液的pH减少,据②中总反应式:Zn +2H+ = Zn2++ H2↑,可知溶液的pH增大。
2Cu+O2↑+4H+,可知溶液的pH减少,据②中总反应式:Zn +2H+ = Zn2++ H2↑,可知溶液的pH增大。
答案:D
本题难度:一般
4、选择题 碳素钢是含碳的铁合金.在潮湿的空气中,碳素钢表面吸附了一层薄薄的水膜.如果水膜中溶解了酸性气体,就使水膜里的H+增多,这时C、Fe和酸性水膜就形成了原电池.在无数个微小的原电池中( )
A.C是正极,发生氧化反应
B.C是负极,发生氧化反应
C.Fe是正极,发生还原反应
D.Fe是负极,发生氧化反应
参考答案:钢铁在潮湿的空气中易发生电化学腐蚀,形成原电池,如果水膜中溶解了酸性气体,就使水膜里的H+增多,这时C、Fe和酸性水膜就形成了原电池,金属发生析氢腐蚀,铁易失电子发生氧化反应而作负极,碳作正极,发生还原反应.
故选D.
本题解析:
本题难度:简单
5、选择题 肼(N2H4)—空气燃料电池是一种环保型碱性燃料电池,电解质为20%~30%的KOH溶液,电池总反应为N2H4+O2=N2+2H2O。下列关于该电池工作时说法中正确的是
A.正极的电极反应式:O2+4H++4e-=2H2O
B.溶液中的阴离子向正极移动
C.负极的电极反应式:N2H4+4OH--4e-=4H2O+N2
D.溶液的pH保持不变
参考答案:C
本题解析:碱性 条件下,燃料电池正极反应式为:O2+2H2O+4e-=4OH-,A项错误;原电池电解质溶液中阴离子向负极移动,B项错误;由总反应式减去正极的电极反应式可得负极的电极反应式为N2H4+4OH--4e-=4H2O+N2,C项正确;反应过程中生成水,故c(OH-)减小,pH减小,D项错误。
本题难度:一般