时间:2017-09-25 17:11:02
1、选择题 在一定温度下,一定量的石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) Ca(OH)2(aq)
Ca(OH)2(aq) Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是( )
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是( )
A.n(Ca2+)增大
B.c(Ca2+)不变
C.c(OH-)增大
D.n(OH-)不变
参考答案:B
本题解析:当向悬浊液中加入CaO,CaO+H2O Ca(OH)2,因为Ca(OH)2已达饱和,随着水的不断反应,还会有Ca(OH)2析出,溶液中Ca2+和OH-的物质的量会减少,但此时溶液依旧是饱和溶液,所以c(Ca2+)不变,B项正确。
Ca(OH)2,因为Ca(OH)2已达饱和,随着水的不断反应,还会有Ca(OH)2析出,溶液中Ca2+和OH-的物质的量会减少,但此时溶液依旧是饱和溶液,所以c(Ca2+)不变,B项正确。
考点:难溶电解质的溶解平衡
本题难度:一般
2、填空题 氧化铁在工业上具有广泛的应用。
I.据报道,一定条件下利用FeO2与甲烷反应可制取“纳米级”的金属铁。其反应如下:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
(1)若反应在2L的密闭容器中进行,5min后达到平衡,测得反应生成Fe的质量为l.12g。则该段时间内CH4的平均反应速率为 ________________。
(2)反应达到平衡后,保持其他条件不变,仅改变某一相关元素,下列说法正确的是___(选填序号)。
a.若加入催化剂,v正增大,平衡向右移动
b.若温度升高,平衡常数K减小
c.若增大Fe2O3的量,平衡向右移动
d.若从反应体系中移走部分CO,可提高CH4的转化率
Ⅱ.工业上利用硫铁矿烧渣(主要成分为Fe2O3、A12O3、SiO2等)为原料提取Fe2O3,工艺
流程如下:试回答下列问题:
(3)步骤i烧渣中A12O3溶解的离子方程式为________________。
(4)步骤i、
参考答案:
本题解析:
本题难度:困难
3、填空题 (1)常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合液的pH=8。混合液中由水电离出的OH-浓度与0.1 mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为?。
(2)相同温度下,将足量硫酸钡固体分别放入相同体积的①0.1 mol·L-1硫酸铝溶液;②0.1 mol·L-1氯化钡溶液;③蒸馏水;④0.1 mol·L-1硫酸溶液中,Ba2+浓度由大到小的顺序是?(用序号填写)。
(3)常温下,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合,当溶液中c(N )=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=?。
)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=?。
参考答案:(1)107∶1? (2)②>③>④>①? (3)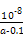
本题解析:(1)0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,恰好生成NaA,水解促进水的电离,已知pH=8,故由水电离出的c(OH-)=10-6;NaOH抑制水的电离,0.1 mol·L-1 NaOH溶液的c(OH-)="0.1" mol·L-1,故由水电离出的c(OH-)=c(H+)=10-13,两者之比为107∶1。(2)一定温度下,c(S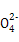 )·c(Ba2+)为定值,c(S
)·c(Ba2+)为定值,c(S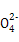 )越小,c(Ba2+)越大,故c(Ba2+)由大到小的顺序是②>③>④>①。(3)根据溶液电中性,c(H+)+c(N
)越小,c(Ba2+)越大,故c(Ba2+)由大到小的顺序是②>③>④>①。(3)根据溶液电中性,c(H+)+c(N )=c(OH-)+c(Cl-),已知c(N
)=c(OH-)+c(Cl-),已知c(N )=c(Cl-)=
)=c(Cl-)=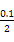 ?mol·L-1,故c(OH-)=c(H+)=10-7 mol·L-1。根据物料守恒,c(NH3·H2O)+c(N
?mol·L-1,故c(OH-)=c(H+)=10-7 mol·L-1。根据物料守恒,c(NH3·H2O)+c(N )=
)= ?mol·L-1,故c(NH3·H2O)=
?mol·L-1,故c(NH3·H2O)=
 -
-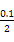
 ?mol·L-1=
?mol·L-1=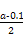 ?mol·L-1。代入Kb=
?mol·L-1。代入Kb=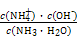 =
=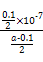 =
=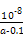 。
。
本题难度:简单
4、选择题 下列有关AgCl沉淀的溶解平衡的说法中,不正确的是
[? ]
A.AgCl沉淀生成和溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低
参考答案:B
本题解析:
本题难度:一般
5、选择题 在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:
Ca(OH)2(固)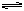 Ca2++2OH-
Ca2++2OH-
当向浑浊液中加入少量的生石灰时,下列说法中正确的是
A.溶液中Ca2+数减少
B.[Ca2+]增大
C.pH不变
D.pH增大
参考答案:A、C
本题解析:该平衡属于溶解平衡,适于化学平衡移动原理。加入CaO时:CaO+H2O=Ca(OH)2,使溶液中水量减少,但由于溶液始终为Ca(OH)2的饱和溶液,即[Ca2+],[OH-]不变,pH不变,那么溶解的Ca(OH)2必须析出,所以Ca2+数减少。
本题难度:一般