时间:2017-09-25 17:08:11
1、选择题 下列化学变化中需加入氧化剂才能实现的是( )
A.Fe→FeCl2
B.SO3→H2SO3
C.Cl2→ClO3-
D.KMnO4→MnCl2
参考答案::A
本题解析:A中Fe的化合价升高,被氧化,需加氧化剂。
B中S、O元素化合价不变,不符合题意。B错误。
C中Cl的化合价降低,被还原,需加还原剂。C错误。
D中Mn的化合价降低,被还原,需加还原剂。D错误。故选A。
考点:氧化还原反应相关概念。
点评:本题考查氧化还原反应,题目难度不大,注意氧化还原反应中,还原剂失去电子,化合价升高,被氧化。
本题难度:一般
2、选择题 下列选用的除杂试剂和实验操作都正确的是(括号内为杂质)
A.NaCl(Na2CO3)加足量稀盐酸、蒸发、结晶
B.CaCl2(CaCO3)加足量稀硫酸、蒸发、结晶
C.Fe(Cu)加足量稀盐酸、过滤、洗涤、干燥
D.MnO2(KCl)加足量水溶解、过滤、洗涤、干
参考答案:AD
本题解析:分析:本题为一种新形式的考题,先根据混合物组成成分的性质差别,分析选用的除杂试剂和实验操作,选择出能达到除杂目的选项,找出一个正确的除杂方法.
解答:A、碳酸钠可以和盐酸反应生成氯化钠、水以及二氧化碳,在蒸发结晶操作下,可以获得氯化钠晶体,故A正确;
B、碳酸钙和硫酸反应生成硫酸钙、水以及二氧化碳,这样会在氯化钙中混进硫酸钙杂质,故B错误;
C、金属Cu不和盐酸发生反应,单质金属铁可以和盐酸发生反应,这样可以将金属铁消耗掉,不符合除杂原则,故C错误;
D、二氧化锰是不溶于水的物质,氯化钾是易溶于水的,所以过滤可以获得二氧化锰固体,故D正确.
故选AD.
点评:依据所掌握的知识进行分析与判断,熟练常见物质的性质及有关使用的注意事项,可以帮助顺利完成此题.
本题难度:简单
3、填空题 洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。
漂白粉是常用的消毒剂。工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 ;漂白粉的有效成分是(填化学式) 。该反应中氧化剂与还原剂物质的量之比是 。
参考答案:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O Ca(ClO)2 1:1
本题解析:漂白粉的制取原理是2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O. 漂白粉的有效成分是Ca(ClO)2.在该反应中。元素的化合价的变化是Cl2的0价→CaCl2的-1价,化合价降低,Cl2作氧化剂;Cl2的0价→Ca(ClO)2的+1价,化合价升高,Cl2作还原剂。该反应中氧化剂与还原剂物质的量之比是1:1.
考点:考查作为饮用水的消毒杀菌剂的漂白粉的制法、有效成分及参加反应的氯气的作用的知识。
本题难度:一般
4、选择题 现有一瓶甲和乙的混合物,已知甲和乙的某些性质如下:
A.萃取法
B.过滤法
C.蒸馏法
D.分液法
参考答案:C
本题解析:分析:甲和乙沸点不同,且相差较大,可用蒸馏的方法分离.
解答:由表中数据可知,甲和乙沸点不同,且相差较大,可用蒸馏的方法分离,而二者都溶于水,则不能用过滤、分液的方法分离.
故选C.
点评:本题考查物质的分离提纯,题目难度不大,注意把握表中数据,根据性质的异同选择分离方法.
本题难度:一般
5、填空题 (12分)用双线桥法标出下列反应中电子转移的方向和数目:
2Al+ 6HCl ="=2" AlCl3 + 3 H2↑
此反应中,还原剂是 , 氧化剂是 ;
元素被氧化。
由此可知,氧化还原反应的实质是
根据你的理解再写一个常见的氧化还原反应的化学方程式:

参考答案:(12分) 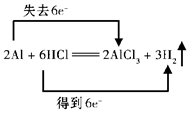
(2分)(不标失去和得到的不得分)Al(2分)、 HCl(2分) Al(2分)
反应过程中有电子转移(得失或偏移)(2分)
CuO+H2D Cu+H2O(2分)(任意写一个氧化还原反应方程式只要正确就可以得分)
本题解析:略
本题难度:一般