时间:2017-09-25 17:07:50
1、选择题 等质量的下列各物质与水反应最平稳、产生H2最多的是
A.Na
B.Li
C.K
D.Rb
参考答案:B
本题解析:因Li的摩尔质量最小,故等质量的四种碱金属中Li与水反应放出H2最多.又因Li的金属性最弱,故与水反应也最平稳.
本题难度:简单
2、选择题 14C常用语测定站生物遗骸的年份.下列说法正确的是( )
A.14C含有14个中子
B.14C与14N含有相同的质子数
C.14C与C60互为同位素
D.14C与12C是两种不同的核素
参考答案:D
本题解析:
本题难度:简单
3、填空题 下表为元素周期表的片段组合,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | 0 1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 2 ② ③ ④ 3 ⑤ ⑥ ⑦ ⑧ | ||||||
参考答案:根据元素在周期表中的分布,可以知道①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl.
(1)微粒电子层越多半径越大,所以Cl->Na+、Al3+,电子排布一样,核电荷数越多半径越小,则Na+>Al3+,故答案为:Cl->Na+>Al3+;
(2)同一周期元素的原子,从左到右最高价氧化物对应水化物的酸性逐渐增强,所以酸性:HNO3>H2CO3,氢氧化铝是两性氧化物,
故答案为:HNO3>H2CO3>Al(OH)3;
(3)O、Na、Si元素形成的硅酸钠时既含离子键又含极性键的一种可溶于水的化合物,化学式为:Na2SiO3 ,故答案为:Na2SiO3 ;
(4)由C与O组成质量比为3:8的化合物是二氧化碳,其结构式是C=O=C,属于直线型的分子晶体,金属镁在二氧化碳中燃烧的反应为:2Mg+CO2?点燃?.?2MgO+C,
故答案为:C=O=C;直线型;分子;2Mg+CO2?点燃?.?2MgO+C;
(5)Al单质与Na的最高价氧化物的水化物氢氧化钠反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
本题解析:
本题难度:简单
4、选择题 X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述中正确的是
[? ]
参考答案:B
本题解析:
本题难度:简单
5、推断题 W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的
ZO两种氧化物。
(1)W位于元素周期表第________周期第________族。W的气态氢化物稳定性比_______H2O(g) (填“强”或“弱”)。
(2)Y的基态原子核外电子排布式是____________,Y的第一电离能比X的________(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是________________________
(4)已知下列数据 
X的单质和FeO反应的热化学方程式是________________________
参考答案:(1)二;VA;弱
(2)ls22s22p63s23p4;大 (3)
(4)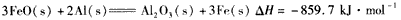
本题解析:
本题难度:一般